
下列說法中錯誤的是
| A.電解飽和食鹽水,生成物總能量比反應物總能量高 |
| B.能自發進行的化學反應,不一定是△H<0,△S>0 |
| C.“冰,水為之,而寒于水”,說明相同質量的水和冰,水的能量高 |
| D.食鹽可用于融化冰雪,且用食鹽作融雪劑不會對環境、植物生長產生任何危害 |
 寒假樂園北京教育出版社系列答案
寒假樂園北京教育出版社系列答案科目:高中化學 來源: 題型:單選題
下列關于能量轉換的認識中不正確的是
| A.原電池工作時化學能全部轉化為電能 |
| B.工業上電解氧化鋁制備鋁,電能轉化成化學能 |
| C.鎂在空氣中燃燒時化學能不只轉變成熱能 |
| D.綠色植物光合作用過程中太陽能轉變成化學能 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列說法或表示方法正確的是
| A.等物質的量的硫蒸氣和硫固體分別完全燃燒,后者放出熱量多 |
| B.由C(石墨)=C(金剛石)△H="+1.90" kJ·mol-1可知,金剛石比石墨穩定 |
| C.在稀溶液中,H+(aq))+OH-(aq))=H2O(l)△H=-57.3 kJ·mol-1,若將含0.5 molH2SO4的濃硫酸與含1 mol NaOH的溶液混合,放出的熱大于57.3 kJ |
| D.在101 kPa時,2 g H2完全燃燒生成液態水,放出285.8 kJ熱量,氫氣燃燒的熱化學方程式表示為:2 H2(g)+O2(g)="2" H2O(1)△H=-285.8 kJ·mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列關于熱化學反應的描述中正確的是
| A.HCl和NaOH反應的中和熱ΔH=-57.3 kJ/mol,則H2SO4和Ca(OH)2反應的中和熱ΔH=2×(-57.3) kJ/mol |
| B.CO(g)的燃燒熱是283.0 kJ/mol,則2CO2(g) =2CO(g)+O2(g)反應的ΔH=+566.0 kJ/mol |
| C.需要加熱才能發生的反應一定是吸熱反應 |
| D.Ba(OH)2·8H2O與NH4Cl反應的焓變小于0,所以在常溫下能自發進行 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列關于燃燒熱和中和熱的比較中,錯誤的是
| A.兩者對應反應的△H均小于0 |
| B.兩者的單位均為kJ·mol-1,但mol-1的含義不同 |
| C.兩者的數值均不隨反應物用量改變而改變 |
| D.兩者的數值均隨反應物改變而改變 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
甲醇質子交換膜燃料電池中將甲醇蒸氣轉化為氫氣的一種反應原理如下:
CH3OH(g) + H2O(g) → CO2(g) + 3H2(g) – 49.0 kJ
下列說法正確的是
| A.1 LCH3OH蒸汽與1 L水蒸汽反應生成1 L CO2氣體與3 L氫氣吸收熱量49.0 kJ |
| B.1個CH3OH分子與1個水分子反應生成1個CO2分子與3個H2分子吸收49.0 kJ熱量 |
| C.相同條件下1molCH3OH(g)與1mol H2O(g)的能量總和小于1molCO2(g)與3 mol H2(g)的能量總和 |
| D.1 molCH3OH蒸汽與1 mol液態水反應生成1mol CO2氣體與3 mol 氫氣吸收的熱量小于49.0 kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列說法正確的是
A.右圖可表示水分解過程中的能量變化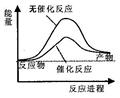 |
| B.若2C(s)+O2(g)=2CO(g)△H=" -221.0" kJ/mol,則碳的燃燒熱為110.5 kJ/mol |
| C.需要加熱的反應一定是吸熱反應,常溫下能發生的反應一定是放熱反應 |
| D.已知:Ⅰ:對于反應:H2(g)+Cl2(s)="2HCl" (g)△H=" -" a kJ/mol, |

查看答案和解析>>
科目:高中化學 來源: 題型:單選題
關于熱化學方程式:2H2(g)+02(g)=2H20(1)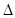 H=-571.6 kJ·mol-1,下列關敘述不正確的是 ( )
H=-571.6 kJ·mol-1,下列關敘述不正確的是 ( )
| A.2mol H2完全燃燒生成液態水放出571.6 kJ的熱 |
| B.1mol H2完全燃燒生成液態水時放出285.8kJ的熱 |
| C.2個氫分子完全燃燒生成液態水時放出571.6 kJ的熱 |
D.上述熱化學方程式可表示為H2(g)+1/2 O2(g)=H20(1),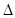 H=-285.8 kJ·mol-1 H=-285.8 kJ·mol-1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com