
 氨是化肥工業和基礎化工的重要原料.請回答下列問題:
氨是化肥工業和基礎化工的重要原料.請回答下列問題:分析 (1)①依據圖象可知A點氨氣平衡含量為50%,其中n(N2):n(H2)=1:3,據此計算此時氨氣物質的量,用平衡分壓代替平衡濃度計算,可以利用氣體物質的量計算平衡常數,平衡常數隨溫度變化,圖象變化趨勢可知隨溫度升高,氨氣含量減小,說明反應是放熱反應,B點溫度高平衡常數小;
②工業上主要用氮氣與氫氣在高溫高壓下合成氨的反應是氣體體積減小的放熱反應,壓強越大平衡正向進行程度越大;
③合成氨的反應是氣體體積減小的放熱反應,常溫下工業原料氣的平衡轉化率比500℃高得多,但反應速率和催化劑的催化作用小,經濟效益低;
(2)依據熱化學方程式和蓋斯定律計算所需熱化學方程式得到反應的焓變;
解答 解:①依據圖象可知A點氨氣平衡含量為50%,其中n(N2):n(H2)=1:3,據此計算此時氨氣物質的量,設氨氣物質的量為x,得到
N2+3H2═2NH3
平衡:1 3 x
$\frac{x}{1+3+x}$=50%
x=4
因為:壓強之比等于物質的量之比
所以:Kp(A)=$\frac{{P}^{2}(N{H}_{3})}{P({N}_{2}){P}^{3}({H}_{2})}$=$\frac{{4}^{2}}{1×{3}^{3}}$=$\frac{16}{27}$
平衡常數只與溫度有關,溫度升高,平衡常數減小,用平衡分壓代替平衡濃度計算,可以利用氣體物質的量計算平衡常數,平衡常數隨溫度變化,圖象變化趨勢可知隨溫度升高,氨氣含量減小,說明反應是放熱反應,B點溫度高平衡常數小,所以:Kp(A)=Kp(C)>Kp(B),
故答案為:$\frac{16}{27}$,Kp(A)=Kp(C)>Kp(B);
②工業上主要用氮氣與氫氣在高溫高壓下合成氨的反應是氣體體積減小的放熱反應,壓強越大平衡正向進行程度越大,圖象分析可知在溫度一定時壓強越大平衡正向進行氨氣的含量增大,所以壓強大小為p1>p2>p3>p4>p5 ,
故答案為:p1>p2>p3>p4>p5;
③合成氨的反應是氣體體積減小的放熱反應,常溫下工業原料氣的平衡轉化率比500℃高得多,但反應速率和催化劑的催化作用小,經濟效益低,實際生產時不采用常溫的原因是反應速率慢,催化劑活性低,經濟效益低,
故答案為:反應速率慢,催化劑活性低,經濟效益低;
(2)①N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1
②N2(g)+2O2(g)?2NO2(g)△H=+67.7kJ•mol-1
③2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1
(③×2-②)×3-①×4得到:8NH3(g)+6NO2(g)?7N2(g)+12H2O(I)△H=-3263.9KJ/mol,
故答案為:-3263.9.
點評 本題考查了化學平衡常數的影響因素和計算分析,圖象的理解應用和影響化學平衡的因素,熱化學方程式書寫方法,掌握基礎是關鍵,題目難度中等.


 黃岡創優卷系列答案
黃岡創優卷系列答案科目:高中化學 來源: 題型:選擇題
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氫氧化鈉溶液 | 醋酸 | 鹽酸 |
| pH | 11 | 11 | 3 | 3 |
| A. | V1L④與V2L②溶液混合后,若混合后溶液pH=4,則V1:V2=9:11 | |
| B. | 由水電離出的c(H+):①=②=③=④ | |
| C. | 分別加水稀釋10倍、四種溶液的pH:①>②>③>④ | |
| D. | 在①、②中分別加入適量的氯化銨晶體后,①的pH減小,②的pH不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
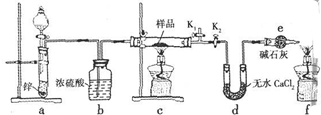
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 化學反應速率可用單位時間內反應物或生成物的物質的量的變化表示 | |
| B. | 硫代硫酸鈉與酸反應,一定產生淡黃色的渾濁現象 | |
| C. | 相同物質的量濃度的硫代硫酸鈉與稀鹽酸反應,其他條件不變,鹽酸濃度越大,產生淡黃色渾濁越快 | |
| D. | 相同物質的量濃度的硫代硫酸鈉與稀硫酸反應,溫度越高,產生淡黃色渾濁越快 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 由X,Y,Z組成的鹽的水溶液中陽離子總濃度大于陰離子總濃度 | |
| B. | YX3的水溶液呈弱堿性,能使濕潤的藍色石蕊試紙變紅 | |
| C. | X與Z形成的化合物的水溶液可用于雕刻玻璃 | |
| D. | W的氯化物熔點低,易升華,但其水溶液能導電,由此推斷它屬于弱電解質 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
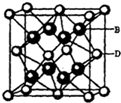 有A、B、C、D、E五種元素.其相關信息如下:
有A、B、C、D、E五種元素.其相關信息如下:| 元素 | 相關信息 |
| A | A原子的1s軌道上只有一個電子 |
| B | B是電負性最大的元素 |
| C | C的基態原子2p軌道有三個未成對電子 |
| D | D為主族元素,且與E同周期,其最外層上有兩個運動狀態不同的電子 |
| E | E能形成紅色(或磚紅色)的E2O和EO兩種氧化物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 ;
;查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com