
【題目】按以下步驟從![]() 合成
合成![]() (部分試劑和反應條件已略去)
(部分試劑和反應條件已略去)
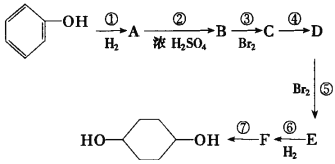
請回答下列問題:
(1)分別寫出B、D的結構簡式:B___、D___。
(2)反應①~⑦中屬于消去反應的是___。(填數字代號)
(3)試寫出C![]() D反應的化學方程式(有機物寫結構簡式,并注明反應條件)___。
D反應的化學方程式(有機物寫結構簡式,并注明反應條件)___。
(4)有機物X的產量是衡量一個國家石油化工發展水平的標志,請以X為原料經過四步反應合成乙酸乙酯___(無機試劑任選,請寫出合成過程并注明反應條件)。
【答案】![]()
![]() ②④
②④ 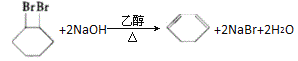
【解析】
由轉化關系可知,![]() 與氫氣發生加成反應生成
與氫氣發生加成反應生成![]() ,則A為
,則A為![]() ;
;![]() 在濃硫酸作用下,共熱發生消去反應生成
在濃硫酸作用下,共熱發生消去反應生成![]() ,則B為
,則B為![]() ;
;![]() 與溴水發生加成反應生成
與溴水發生加成反應生成![]() ;則C為
;則C為![]() ;
;![]() 在氫氧化鈉醇溶液中共熱發生消去反應生成
在氫氧化鈉醇溶液中共熱發生消去反應生成![]() ;則D為
;則D為![]() ;
;![]() 與溴水發生1,4—加成反應生成
與溴水發生1,4—加成反應生成![]() ,則E為
,則E為![]() ;
;![]() 與氫氣發生加成反應生成
與氫氣發生加成反應生成![]() ,則F為
,則F為![]() ;
;![]() 在氫氧化鈉溶液中發生水解反應生成
在氫氧化鈉溶液中發生水解反應生成 。
。
(1)由以上分析可知B為![]() ,D為
,D為![]() ,故答案為:
,故答案為:![]() ;
;![]() ;
;
(2)根據以上反應關系可知①為加成反應,②為消去反應,③為加成反應,④為消去反應,⑤為加成反應,⑥為加成反應,⑦為取代反應,則屬于消去反應為的為②④,故答案為:②④;
(3)C→D的反應為![]() 在氫氧化鈉醇溶液中共熱發生消去反應生成
在氫氧化鈉醇溶液中共熱發生消去反應生成![]() ,反應的化學方程式為
,反應的化學方程式為 ,故答案為:
,故答案為: ;
;
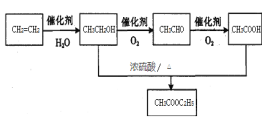
(4)乙烯為有機原料合成乙酸乙酯的步驟為:乙烯和水發生加成反應生成乙醇,乙醇在Cu、加熱條件下發生催化氧化生成乙醛,乙醛進一步氧化為乙酸,乙醇與乙酸發生酯化反應成乙酸乙酯,合成路線如下: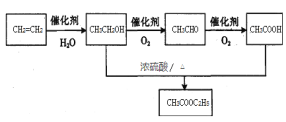 ,故答案為:
,故答案為: 。
。


科目:高中化學 來源: 題型:
【題目】隨著科學技術的發展,阿伏加德羅常數的測定手段越來越多,測定精確度也越來越高,現有一種簡單可行的測定方法,具體步驟為:
(1)將固體NaCl研細、干燥后,準確稱取mgNaCl固體并轉移到定容儀器A中。
(2)用滴定管向A儀器中滴加苯,不斷振蕩,繼續加苯至A儀器的刻度線,計算出NaCl固體的體積為Vcm3。
①步驟(1)中A儀器最好用__________(儀器名稱)。
②步驟(2)中用酸式滴定管好還是堿式滴定管好,__________,理由是______________。
③能否用膠頭滴管代替步驟(2)中的滴定管__________;理由是____________________。
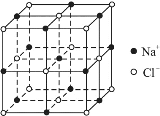
④已知NaCl晶體的結構如上圖所示,用X射線測得NaCl晶體中靠得最近的Na+與Cl-間的平均距離為acm,則用上述測定方法測得阿伏加德羅常數NA的表達式為:NA=______mol-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】錳酸鋰離子蓄電池是第二代鋰離子動力電池。一種以軟錳礦漿(主要成分為MnO2,含少量Fe2O3、FeO、A12O3、SiO2等雜質)為原料制備錳酸鋰的流程如圖所示。
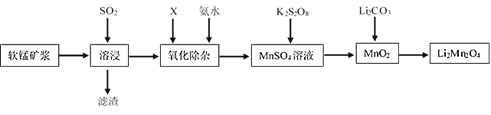
(1)溶浸生產中為提高SO2回收率可采取的措施有__(填序號)
A.不斷攪拌,使SO2和軟錳礦漿充分接觸
B.增大通入SO2的流速
C.減少軟錳礦漿的進入量
D.減小通入SO2的流速
(2)已知:室溫下,Ksp[A1(OH)3]=1×10-33,Ksp[Fe(OH)3]=l×10-39,pH=7.1時Mn(OH)2開始沉淀。氧化除雜時(室溫)除去MnSO4液中的Fe3+、Al3+(使其濃度小于1×l0-6mol/L),需調節溶液pH范圍為__。
(3)由硫酸錳與K2S2O8溶液常溫下混合一周,慢慢得到球形二氧化錳(MnO2)。請寫出發生反應的離子方程式__。
(4)將MnO2和Li2CO3按4:1的物質的量比配料,混合攪拌,然后升溫至600℃750℃,制取產品LiMn2O4。寫出該反應的化學方程式__。
(5)錳酸鋰可充電電池的總反應為:Li1-xMn2O4+LixC![]() LiMn2O4+C(0<x<1)
LiMn2O4+C(0<x<1)
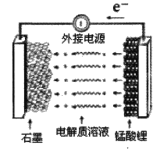
①充電時,電池的陽極反應式為__,若此時轉移lmole-,則石墨電極將增重__g。
②廢舊錳酸鋰電池可能殘留有單質鋰,拆解不當易爆炸、著火,為了安全,對拆解環境的要求是__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“中國芯”的發展離不開單品硅,四氯化硅是制備高純硅的原料、某小組擬在實驗室用下列裝置模擬探究四氯化的制備和應用(夾持裝置已省略)。
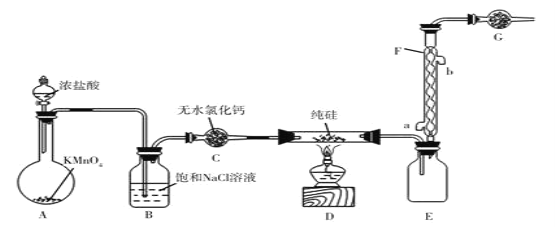
已知有關信息:
①Si+3HCl![]() SiHCl3+H2,Si+2Cl2
SiHCl3+H2,Si+2Cl2![]() SiCl4
SiCl4
②SiCl4遇水劇烈水解,SiCl4的熔點、沸點分別為-70.0℃、57.7℃
請回答下列問題
(1)裝濃鹽酸的儀器名稱是________________。
(2)寫出A中發生反應的離子方程式________________。
(3)若拆去B裝置,可能的后果是________________(寫出一個即可)。
(4)有同學最初將E、F、G裝置設計成圖Ⅱ裝置,圖Ⅱ裝置的主要缺點是________________。(寫出一個即可)

(5)已知NH4Cl在高溫條件下易分解生成NH3和HCl。利用SiCl4和NH3制備新型無機非金屬材料(Si3N4)的裝置如圖III。寫出該反應的化學方程式:________________利用尾氣制備鹽酸,宜選擇下列裝置中的________________(填字母)。

(6)取少量SiCl4產品溶于足量蒸餾水中生成硅酸,該反應的化學方程式為________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物結構簡式為: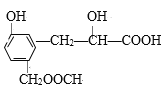 ,它可能發生的反應有:①加成反應;②取代反應;③還原反應;④水解反應;⑤中和反應;⑥顯色反應;⑦氧化反應;⑧消去反應;其中正確的是( )
,它可能發生的反應有:①加成反應;②取代反應;③還原反應;④水解反應;⑤中和反應;⑥顯色反應;⑦氧化反應;⑧消去反應;其中正確的是( )
A.③⑤⑥⑦B.全部C.④⑤⑥⑦D.除①④外其余都有
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞硝酰氯(NOCl)是有機物合成中的重要試劑,為紅褐色液體或黃色氣體,具有刺鼻惡臭味,遇水反應生成一種烈化物和兩種氧化物。某學習小組在實驗用C12和NO制備NOCl并測定其純度,相關實驗(裝置略去)如下。請回答:
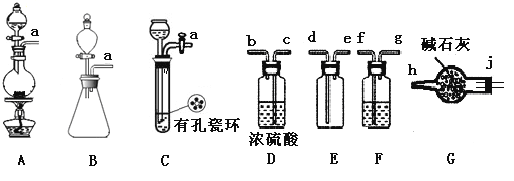
(1)制備Cl2發生裝置可______ (填大寫字母),反應的離子方程式為_______。
(2)欲收集一瓶干燥的氯氣,選擇裝置,其連接順序為:a→________(按氣流方向,用小寫字母表示),若用到F,其盛裝藥品為_________。
(3)實驗室可用下圖裝置制備亞硝酰氯(NOCl)
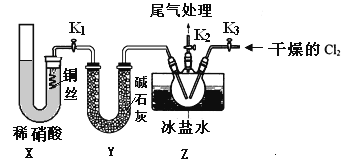
①實驗室也可用B裝置制備NO,上圖X裝置的優點為__________(至少寫出兩點)
②檢驗裝置氣密性并裝入藥品,打開k2,然后再打開____(填“k1”或“k3”),通入一段時間氣體,其目的為________,然后進行其他操作,當Z有一定量液體生成時,停止實驗。
③若無裝肖Y,則Z中NOCl可能發生反應的化學方程式為_________
(4)取Z中所得液體mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液為指示劑,用cmol/LAgNO3標準溶液滴定至終點,消耗標準溶液的體積為22.50mL.已知:Ag2CrO4為磚紅色固體;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12,則亞硝酰氯(NOC1)的質量分數為____(用代數式表示,不必化簡)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知NA為阿伏加德羅常數的值,下列說法正確的是
A.3g由CO2和SO2組成的混合氣體中含有的質子數為1.5NA
B.1L0.1molL-1 Na2SiO3溶液中含有的SiO32-數目為0.1NA
C.0.1molH2O2分解產生O2時,轉移的電子數為0.2NA
D.2.8g聚乙烯中含有的碳碳雙鍵數目為0.1NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設![]() 為阿伏加德羅常數的數值,下列說法正確的是( )
為阿伏加德羅常數的數值,下列說法正確的是( )
A.100g 46%甘油水溶液中含—OH的數目為1.5NA
B.1.7g由NH3與13CH4組成的混合氣體中含質子總數為NA
C.0.1molL-1的Al2(SO4)3溶液中含Al3+的數目小于0.2 NA
D.反應CH4 + 2NO + O2 = CO2 + N2 + 2H2O,每消耗標準狀況下22.4L NO,反應中轉移的電子數目為2 NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應中,屬于消去反應的是
A.CH2=CH2+HCl 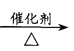 CH3CH2Cl
CH3CH2Cl
B.CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
C.![]() +Br2
+Br2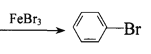 +HBr
+HBr
D.CH3CH2Br+NaOH![]() CH2=CH2+NaBr+H2O
CH2=CH2+NaBr+H2O
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com