
(共4分)在一個固定體積為2升的密閉容器中,充入2molA和1molB, 發 生如下反應: 2A(g)+B(g) 3C(g)+D(s),2分鐘反應達到平衡,此時C的濃度為1.2 mol/L。
3C(g)+D(s),2分鐘反應達到平衡,此時C的濃度為1.2 mol/L。
(1)2分鐘內用B表示的平均反應速度為 ;
(2)若容器溫度升高,平衡時混合氣體的平均相對摩爾質量減小,則正反應為: (填“吸熱”或“放熱”)反應。
(各2分,共4分)
(1)0.2mol/(L.min)(不寫單位或錯寫單位扣1分); (2)吸熱。
解析試題分析:(1)2min內C的濃度增加1.2mol/L,則B的濃度減少1.2mol/L×1/3=0.4mol/L,所以2分鐘內用B表示的平均反應速度為0.4mol/L/2min=0.2 mol/(L.min);
(2)根據發生的化學反應方程式可知,盡管氣體的物質的量在反應前后沒變化,但產物中有固體生成,所以正向是氣體的質量減少的方向,則氣體的平均摩爾質量在減小,所以升高溫度,平衡時混合氣體的平均相對摩爾質量減小,說明升溫平衡正向移動,所以正反應是吸熱反應。
考點:考查反應速率的計算,反應熱效應的判斷


 數學奧賽暑假天天練南京大學出版社系列答案
數學奧賽暑假天天練南京大學出版社系列答案 南大教輔搶先起跑暑假銜接教程南京大學出版社系列答案
南大教輔搶先起跑暑假銜接教程南京大學出版社系列答案科目:高中化學 來源: 題型:單選題
密閉容器中,反應xA(g)+yB(g)  zC(g)達平衡時,A的濃度為0.5mol/L,若保持溫度不變,將容器的容積擴大到原來的2倍,達新平衡時A的濃度降為0.3mol/L下列判斷錯誤的是 ( )
zC(g)達平衡時,A的濃度為0.5mol/L,若保持溫度不變,將容器的容積擴大到原來的2倍,達新平衡時A的濃度降為0.3mol/L下列判斷錯誤的是 ( )
| A.x+y>z | B.平衡向正方向移動 |
| C.B的轉化率降低 | D.C的體積分數下降 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(7分)CO可用于合成甲醇,一定溫度下,向體積為2L的密閉容器中加入CO和H2,發生反應CO(g)+2H2(g) CH3OH(g),達平衡后測得各組分濃度如下:
CH3OH(g),達平衡后測得各組分濃度如下:
| 物質 | CO | H2 | CH3OH |
| 濃度(mol?L-1) | 0.9 | 1.0 | 0.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(2分)某溫度時,在2L固定體積的密閉容器中X、Y、Z三種氣體隨時間的變化如圖所示: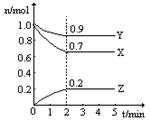
(1)該反應的化學方程式為 ;
(2)下列表示該反應速率最大的是
A.v(X)=0.6mol/(L·s) B.v(Y)=0.3mol/(L·s) C.v(Z)=0.5mol/(L·s)
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(8分)水煤氣不僅是合成氨的原料氣也是合成烴及其化工產品的原料。
(1)直接水煤氣燃料電池中,通CO、H2的極為電池的 極(選填:“正”,“負”)。
(2)水煤氣變換反應:CO(g) + H2O(g)  CO2(g) + H2(g) △H < 0,下列措施能提高反應速率的有 (不定項選擇)。
CO2(g) + H2(g) △H < 0,下列措施能提高反應速率的有 (不定項選擇)。
a.升高溫度 b.加入催化劑 c.增大壓強 d.降低濃度
(3)H2和N2在催化劑、高溫高壓條件下合成氨的化學方程式為 。
(4)氨氣的水溶液可用于吸收煙道氣中的二氧化硫,該反應的化學方程式為 。
(5)將標準狀況下582.4L合成氣(已知:n(CO)∶n(H2)=4∶9)通入合成塔,一定條件下可發生2CO(g)+ 4H2(g) → CH2=CH2(g)+2H2O(g);CO(g)+3H2→CH4(g)+H2O(g),充分反應后,經測定產品中只有甲烷、乙烯和水蒸氣(假定CO和H2均無剩余),試計算逸出的氣體中乙烯的物質的量(列出計算過程)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(6分) 在一定溫度下,將4mol SO2與2molO2放入4L的密閉容器中,在一定條件下反應,10分鐘時達到平衡: 2SO2 + O2 2SO3 測得平衡時混合物總物質的量為5mol,求:
2SO3 測得平衡時混合物總物質的量為5mol,求:
(1)10分鐘時O2的反應速率為 mol/(L·min)(2)平衡時SO2的轉化率
(3) 平衡常數K為多少
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(10分)將一定量的SO2和含0.7mol氧氣的空氣(忽略CO2)放入0.5 L密閉容器內,550℃時,在催化劑作用下發生反應: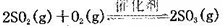 (正反應放熱)。測得n(O2)隨時間的變化如下表
(正反應放熱)。測得n(O2)隨時間的變化如下表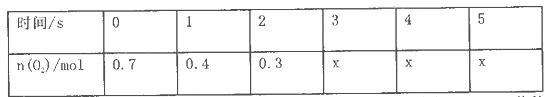
反應達到5s后,將容器中的混合氣體通過過量NaOH溶液,氣體體積減少了22. 4L(此體積為標準狀況下的體積);再將剩余氣體通過焦性沒食子酸的堿性溶液吸收O2,氣體的體積又減少了5.6L(此體積為標準狀況下的體積)。
請回答下列問題:
(1)用O2表示從0-ls內該反應的平均反應速率為__________________。
(2)O2的平衡濃度c (O2)=____________________________;
(3) 4s時,SO2的生成速率____________(填“大于”、“小于”或“等于”)O2的消耗速率。
(4)求該反應達到平衡時SO2的轉化率是________(用百分數表示)。
(5)若將平衡混臺氣體中SO3的5%通入過量的BaCl2溶液,生成沉淀_______克(計算結果保留一位小數)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(15分)已知化學平衡、電離平衡、水解平衡和溶解平衡均符合勒夏特列原理。請回答下列問題:
(1)可逆反應FeO(s)+CO(g) Fe(s)+CO2(g)是煉鐵工業中一個重要反應,其溫度與平衡常數K的關系如下表:
Fe(s)+CO2(g)是煉鐵工業中一個重要反應,其溫度與平衡常數K的關系如下表:
| T(K) | 938 | 1100 |
| K | 0.68 | 0.40 |
| 溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com