
【題目】Ⅰ.已知將鹽酸滴入高錳酸鉀溶液中,產生黃綠色氣體,而溶液的紫紅色褪去。現有一個氧化還原反應的體系中共有KCl、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 七種物質:
七種物質:
(1)寫出一個包含上述七種物質的氧化還原反應方程式:____________。
(2)上述反應中,1mol氧化劑在反應中得到________mol電子。
(3)如果在反應后的溶液中加入![]() ,溶液又變紫紅色。已知鉍有
,溶液又變紫紅色。已知鉍有![]() 、
、![]() 價,其中
價,其中![]() 價較穩定,寫出加入
價較穩定,寫出加入![]() 溶液又變紫紅色的離子方程式:_________。由上述方程式說明
溶液又變紫紅色的離子方程式:_________。由上述方程式說明![]() 的一個性質:__________。
的一個性質:__________。
II.(1)已知![]() 能與次氯酸鹽發生如下反應(未配平)
能與次氯酸鹽發生如下反應(未配平)![]() 。
。
①已知有10.7gFe(OH)3參加反應,共轉移了![]() 個電子,則
個電子,則![]() ________。
________。
②根據所學的知識,推測![]() 能和下列________
能和下列________![]() 填序號
填序號![]() 物質反應。
物質反應。
A.![]() B.SO2 C.
B.SO2 C.![]() D.
D.![]()
(2)一定條件下,向含硝酸的廢水中加入![]() ,將
,將![]() 還原成
還原成![]() 。若該反應消耗32gCH3OH,轉移6mol電子,則參加反應的還原劑和氧化劑的物質的量之比是________。
。若該反應消耗32gCH3OH,轉移6mol電子,則參加反應的還原劑和氧化劑的物質的量之比是________。
【答案】![]()
![]()
![]()
![]() 的氧化性比
的氧化性比![]() 的氧化性強
的氧化性強 ![]()
![]()
![]()
【解析】
Ⅰ(1)已知將鹽酸滴入高錳酸鉀溶液中,產生黃綠色氣體,而溶液的紫紅色褪去,說明高錳酸鉀可以將鹽酸氧化為氯氣。同理,高錳酸鉀在酸性條件下可以將氯離子氧化為氯氣;
(2)在反應中,![]() 作氧化劑,反應前后,Mn元素的化合價由
作氧化劑,反應前后,Mn元素的化合價由![]() 價降低為
價降低為![]() 價,由此可求出1molKMnO4在反應中得到電子的物質的量;
價,由此可求出1molKMnO4在反應中得到電子的物質的量;
(3)在反應后的溶液中加入![]() ,溶液又變紫紅色,說明
,溶液又變紫紅色,說明![]() 將二價錳離子氧化為高錳酸根離子;根據同一反應中氧化劑的氧化性強于氧化產物的氧化性可得:
將二價錳離子氧化為高錳酸根離子;根據同一反應中氧化劑的氧化性強于氧化產物的氧化性可得:![]() 的氧化性比
的氧化性比![]() 的氧化性強,可寫出反應方程式;
的氧化性強,可寫出反應方程式;
Ⅱ.(1)①10.7gFe(OH)3的物質的量為![]() ,轉移
,轉移![]() 個電子,即Fe元素化合價升高3價,從而求出n值;
個電子,即Fe元素化合價升高3價,從而求出n值;
②根據所學的知識,推測![]() 中Fe元素的化合價為
中Fe元素的化合價為![]() 價,有較強的氧化性,可以和還原性物質反應,從而確定還原劑;
價,有較強的氧化性,可以和還原性物質反應,從而確定還原劑;
(2) 32gCH3OH的物質的量為:![]() ,作還原劑,轉移6mol電子,而1molHNO3作氧化劑轉化為
,作還原劑,轉移6mol電子,而1molHNO3作氧化劑轉化為![]() 轉移5mol電子,從而求出參加反應的還原劑和氧化劑的物質的量之比。
轉移5mol電子,從而求出參加反應的還原劑和氧化劑的物質的量之比。
Ⅰ(1)已知將鹽酸滴入高錳酸鉀溶液中,產生黃綠色氣體,而溶液的紫紅色褪去,說明高錳酸鉀可以將鹽酸氧化為氯氣,則同理,高錳酸鉀在酸性條件下可以將氯離子氧化為氯氣,得出方程式為:![]() ,故答案為:
,故答案為:![]() ;
;
(2)在反應![]() 中,
中,![]() 作氧化劑,反應前后,Mn元素的化合價由
作氧化劑,反應前后,Mn元素的化合價由![]() 價降低為
價降低為![]() 價,
價,![]() 在反應中得到5mol電子,故答案為:5;
在反應中得到5mol電子,故答案為:5;
(3)在反應后的溶液中加入![]() ,溶液又變紫紅色,說明
,溶液又變紫紅色,說明![]() 將二價錳離子氧化為高錳酸根離子,反應的離子方程式為:
將二價錳離子氧化為高錳酸根離子,反應的離子方程式為:![]() ;根據同一反應中氧化劑的氧化性強于氧化產物的氧化性可得:
;根據同一反應中氧化劑的氧化性強于氧化產物的氧化性可得:![]() 的氧化性比
的氧化性比![]() 的氧化性強,故答案為:
的氧化性強,故答案為:![]() ;
;![]() 的氧化性比
的氧化性比![]() 的氧化性強;
的氧化性強;
Ⅱ①10.7gFe(OH)3的物質的量為![]() ,轉移
,轉移![]() 個電子,即Fe元素化合價升高3價,則
個電子,即Fe元素化合價升高3價,則![]() ,故答案為:2;
,故答案為:2;
②根據所學的知識,推測![]() 中Fe元素的化合價為
中Fe元素的化合價為![]() 價,有較強的氧化性,可以和還原性物質反應,而AD兩項是常見的氧化劑,BC兩項是常見的還原劑,故答案為:BC;
價,有較強的氧化性,可以和還原性物質反應,而AD兩項是常見的氧化劑,BC兩項是常見的還原劑,故答案為:BC;
(2) 32gCH3OH的物質的量為:![]() ,作還原劑,轉移6mol電子;而1molHNO3作氧化劑轉化為
,作還原劑,轉移6mol電子;而1molHNO3作氧化劑轉化為![]() 轉移5mol電子,則參加反應的還原劑和氧化劑的物質的量之比是
轉移5mol電子,則參加反應的還原劑和氧化劑的物質的量之比是![]() ,故答案為:
,故答案為:![]() 。
。


科目:高中化學 來源: 題型:
【題目】水的電離平衡如圖所示.

(1)若A點表示25℃時水的電離平衡狀態,當升高溫度至100℃時水的電離平衡狀態為B點,則此時水的離子積為___________
(2)將100℃時pH=8的Ba(OH)2溶液與pH=5的鹽酸混合,并保持100℃的恒溫,欲使混合溶液的pH=7,則Ba(OH)2溶液與鹽酸的體積比為_________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲、乙、丙、丁為中學常見物質,其中甲、乙為單質,丙為氧化物,它們之間存在如圖所示的轉化關系:
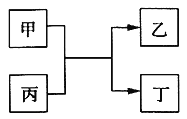
下列說法正確的是( )
A. 若甲、乙元素是同主族元素,根據元素周期表推測,此時乙單質可能是Si
B. 若甲、乙均為金屬單質,則丁所屬的物質類別一定是堿性氧化物
C. 若甲為金屬單質,乙為非金屬單質,則甲只能是Mg
D. 若甲、乙元素是同周期元素,則該反應的化學方程式一定為:2F2 + 2H2O=4HF + O2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求作答
(1)鈷位于元素周期表的第__族,其基態原子中未成對電子個數為__。
(2)[Fe(H2NCONH2)6](NO3)3的名稱是三硝酸六尿素合鐵(Ⅲ),是一種重要的配合物。該化合物中Fe3+的核外電子排布式為__,所含非金屬元素的電負性由大到小的順序是__。
(3)尿素[CO(NH2)2]分子中σ鍵與π鍵的數目之比為__。
(4)硒、硅均能與氫氣化合形成氣態氫化物,若“Si-H”中共用電子對偏向氫,氫氣與硒反應時,硒單質做氧化劑,則硒與硅的電負性大小為Se__Si(填“>”或“<”)
(5)與Si同周期部分元素的逐級電離能如圖所示,其中a、b和c分別代表__。

A.a為I1、b為I2、c為I3 B.a為I2、b為I3、c為I1
C.a為I3、b為I2、c為I1 D.a為I1、b為I3、c為I2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】丁苯酞(J)是治療輕、中度急性腦缺血的藥物,合成J的一種路線如圖:
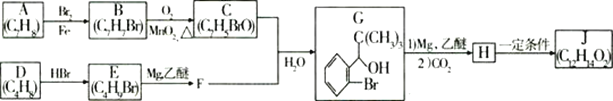
已知:①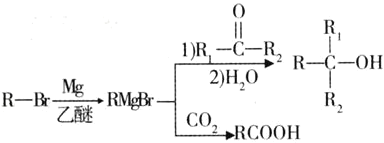
②E的核磁共振氫譜只有一組峰
③C能發生銀鏡反應
④J是一種酯,分子中除苯環外還含有一個五元環
⑤苯環上的鹵原子在常壓下遇到NaOH的溶液很難水解
回答下列問題:
(1)G中官能團的名稱:___、__。
(2)D的系統命名是__;J的結構簡式為__。
(3)由A生成B的化學方程式為__,反應類型為__。
(4)C與新制的氫氧化銅懸濁液反應的化學方程式為__。
(5)H在一定條件下生成高分子化合物的結構簡式為__。
(6)G的同分異構體中核磁共振氫譜有4組峰,且能與FeCl3溶液發生顯色反應,任寫出其中兩種符合上述條件的同分異構體的結構簡式__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求填空:
(1)FeO·Cr2O3+NaNO3![]() Na2CrO4+ Fe2O3+ CO2↑+NaNO2,上述反應配平后,FeO·Cr2O3與NaNO3的系數比為________,該反應的氧化產物為_____________,該步驟不能使陶瓷容器,用反應式說明:_________。
Na2CrO4+ Fe2O3+ CO2↑+NaNO2,上述反應配平后,FeO·Cr2O3與NaNO3的系數比為________,該反應的氧化產物為_____________,該步驟不能使陶瓷容器,用反應式說明:_________。
(2)完成下列反應_____ MnO4—+H2O2+___=Mn2++__+H2O。
(3)Na2CO3溶液中通入足量Cl2,寫出其離子反應方程式:_______________。
(4)將0.03mol Fe3O4完全溶解在200ml3. 00mol/L硫酸中,然后加入20.00ml K2Cr2O7溶液,
恰好使Fe2+全部轉化為Fe3+,且Cr2O72—中的鉻全部轉化為Cr3+,則, K2Cr2O7的物質的量濃度是________。
(5)用離子反應方程式表示泡沫滅火器的反應原理:__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 將0.10 mol·L-1氨水加水稀釋后,溶液中c(NH![]() )·c(OH-)變大
)·c(OH-)變大
B. 為確定某酸H2A是強酸還是弱酸,可測NaHA溶液的pH。若pH>7,則H2A是弱酸;若pH<7,則H2A是強酸
C. 將CH3COOH溶液加水稀釋后,溶液中![]() 變大
變大
D. 用0.200 0 mol·L-1NaOH標準溶液滴定HCl與CH3COOH的混合溶液(混合溶液中兩種酸的濃度均為0.1 mol·L-1),至中性時,溶液中的酸未被完全中和
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在混合體系中,確認化學反應先后順序有利于問題的解決,下列反應先后順序判斷正確的是( )
A.在含等物質的量的FeBr2、FeI2的溶液中緩慢通入Cl2:![]() 、
、![]() 、
、![]()
B.在含等物質的量的![]() 、
、![]() 、
、![]() 的溶液中加入Zn:
的溶液中加入Zn:![]() 、
、![]() 、
、![]() 、
、![]()
C.在含等物質的量的![]() 、KOH的溶液中通入
、KOH的溶液中通入![]() :
:![]() 、KOH、BaCO3、
、KOH、BaCO3、![]()
D.在含等物質的量的AlO2-、![]() 、
、![]() 溶液中,逐滴加入鹽酸:
溶液中,逐滴加入鹽酸:![]() 、
、![]() 、AlO2-、
、AlO2-、![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,濃度均為![]() 的4種鈉鹽溶液pH如下:下列說法不正確的是( )
的4種鈉鹽溶液pH如下:下列說法不正確的是( )
溶質 |
|
| NaClO |
|
pH |
|
|
|
|
A.四種溶液中,![]() 溶液中水的電離程度最大
溶液中水的電離程度最大
B.![]() 溶液顯酸性的原因是:
溶液顯酸性的原因是:![]()
C.向氯水中加入少量![]() ,可以增大氯水中次氯酸的濃度
,可以增大氯水中次氯酸的濃度
D.常溫下,相同物質的量濃度的![]() 、
、![]() 、HClO,pH最小的是
、HClO,pH最小的是![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com