
【題目】I.髙錳酸鉀在實驗室和工農業生產中有廣泛的用途,實驗室以二氧化錳為主要原料制備高錳酸鉀,其部分流程如下:

(1)第①步加熱熔融應在鐵坩堝中進行,而不用瓷坩堝的原因是_______________________________(用化學方程式表示)。
(2)第④步通人適量CO2,發生反應生成MnO4-、MnO2和碳酸鹽,則發生反應的離子方程式為_______________________________。
(3)第⑥步加熱濃縮至液面有細小晶體析出時,停止加熱,冷卻結晶、過濾、洗滌、干燥,干燥過程中,溫度不宜過高,其原因是_________________(用化學方程式表)。
(4)H2O2和KMnO4都是常用的強氧化劑,若向H2O2溶液中滴加酸性髙錳酸鉀溶液,則酸性髙錳酸鉀溶液會褪色,寫出該反應的離子方程式: ________________________________。
II.某小組設計如圖所示的裝置圖(圖中夾持和加熱裝置略去),分別研究SO2和C12的性質。

(5)若從左端分別通入SO2和C12,裝置A中觀察到的現象是否相同______(填“相同”或“不相同”)。
(6)若裝置B中裝有5.0 mL 1.0 mol L-1的碘水,當通入足量Cl2完全反應后,共轉移了5. 0×10-2 mol電子,則該反應的化學方程式為____________________________。
(7)若由元素S和O組成-2價酸根離子X,X中S和O的質量比為4 : 3;當Cl2與含有X的溶液完全反應后,有淺黃色沉淀產生,取上層清液加人氯化鋇溶液,有白色沉淀產生。 寫出Cl2與含有X的溶液反應的離子方程式: __________________________。
【答案】 SiO2+ 2KOH![]() K2SiO3+H2O 3MnO42-+2CO2 =2MnO4-+MnO2↓+2CO32- 2KMnO4
K2SiO3+H2O 3MnO42-+2CO2 =2MnO4-+MnO2↓+2CO32- 2KMnO4![]() K2MnO4+MnO2+O2↑ 2MnO4-+6H++5H2O2==2Mn2++5O2↑十+8H2O 相同 5Cl2+I2+6 H2O =2 HIO3+10HCl S2O32-+Cl2+ H2O==SO42-+S↓+2C1- +2H+
K2MnO4+MnO2+O2↑ 2MnO4-+6H++5H2O2==2Mn2++5O2↑十+8H2O 相同 5Cl2+I2+6 H2O =2 HIO3+10HCl S2O32-+Cl2+ H2O==SO42-+S↓+2C1- +2H+
【解析】試題分析:(1)由于KOH是強堿,在加熱及高溫時容易與玻璃、陶瓷中的SiO2發生反應,該反應的方程式為SiO2+2KOH![]() K2SiO3+H2O ,所以加熱熔融KClO3和KOH的混合物應在鐵坩堝中進行。
K2SiO3+H2O ,所以加熱熔融KClO3和KOH的混合物應在鐵坩堝中進行。
(2)根據題意結合原子守恒和電荷守恒,可得該反應的方程式為:3MnO42-+2CO2=2MnO4-+MnO2↓+2CO32-;
(3)由于KMnO4受熱容易發生分解反應:2KMnO4![]() K2MnO4+MnO2+O2↑,為了防止KMnO4的分解,所以在干燥時溫度不宜過高。
K2MnO4+MnO2+O2↑,為了防止KMnO4的分解,所以在干燥時溫度不宜過高。
(4)KMnO4和H2O2都有強的氧化性,但KMnO4的氧化性更強,所以二者發生反應時H2O2作還原劑,把KMnO4還原為無色的Mn2+,而使溶液褪色,反應的離子方程式為2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O;
(5)SO2具有漂白性,能使品紅褪色,Cl2具有強氧化性,能將品紅氧化而使品紅褪色,所以若從左端分別通人SO2和Cl2,裝置A中觀察到的現象相同;
(6)根據題意,氯氣和碘水反應,氯氣的氧化性強于碘,在反應中得電子,碘的物質的量為0.005×1=0.005mol,轉移的電子數為5.0×10-2 mol,則1molI2轉移10mol電子,即碘由0價失電子生成+5價碘酸,所以該反應的化學方程式為5Cl2+I2+6H2O =2HIO3+10HCl;
(7)若由元素S和O組成-2價酸根離子X,X中S和O的質量比為4:3,則X為S2O32-,當Cl2與含X的溶液完全反應后,有淺黃色沉淀產生,說明有S生成,取上層清液加入氯化鋇溶液,有白色沉淀產生,說明有SO42-生成,則Cl2與含S2O32-的溶液反應的離子方程式為S2O32-+Cl2+H2O =SO42-+S↓+2Cl-+2H+。


科目:高中化學 來源: 題型:
【題目】湖泊發生水華現象,其原因是水體出現富營養化,使某些藻類迅速繁殖,導致水生生
態系統的破壞。下列選項中能夠使水富營養化的物質是( )
A.含氯的化合物B.含氮、磷的化合物
C.含硫的化合物D.含碳的有機物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W四種短周期元素在元素周期表中的位置關系如下圖:

I .若Z元素原子的最外層電子數是電子層數的2倍。
(1)寫出銅和X的最髙價氧化物的水化物的稀溶液反應的離子方程式:_______________________。
(2)W最高價氧化物的水化物的濃溶液不穩定,受熱可分解,產物之一是黃綠色氣體,且當有28 mol電子發生轉移時,共產生9 mol氣體,寫出該反應的化學方程式:_________________________。
II.若Y和Z的核外電子數之和為22。
(3)Y的氣態氫化物的電子式為___________,工業合成該物質的化學方程式為_____________________。
(4)X的單質與W的最高價氧化物的水化物的濃溶液反應,當電子轉移0.4 mol時,產生氣體的體積是__________________________(標準狀況)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于有機化合物的說法正確的是( )
A.乙醇是一種可再生能源
B.汽油、柴油和植物都是碳氫化合物
C.苯能使酸性的KMnO4溶液褪色
D.甲烷、乙烯和苯在工業上都可通過石油分餾得到
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是
A. 1mol H2O的質量為18g
B. 摩爾是表示物質微粒數目的一個物理量
C. 3.01×1023個SO2分子的質量為64g
D. 標準狀況下,1mol任何物質體積均約為22.4L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲、乙、丙、丁、戊是中學常見的無機物,其中甲、乙均為單質,它們的轉化關系如下圖所示(某些條件和部分產物已略去)。下列說法不正確的是
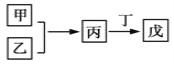
A. 若甲既能與鹽酸反應又能與NaOH溶液反應則丙可能屬于兩性氧化物
B. 若甲為短周期中原子半徑最大的主族元素的單質,且戊為堿,則丙只能為Na2O2
C. 若丙、丁混合產生白煙,且丙為18電子分子,丁為10電子分子,則乙的水溶液可能具有漂白作用
D. 若甲、丙、戊含有同一種元素,則三種物質中,該元素的化合價由低到高的順序可能為甲<丙<戊
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質加熱熔化時,所克服粒子間相互作用力屬于同類型的是( )
A. 食鹽和金屬鈉的熔化B. 氯化銨和單質硫的熔化
C. 碘和干冰的升華D. 金剛石和石灰石的熔化
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com