
【題目】下列化學方程式書寫錯誤的是( )
A. Na2CO3+2HCl= 2NaCl+H2O+CO2↑B. CO2+Ca(OH)2=CaCO3↓+H2O
C. CuSO4+ BaOH=CuOH↓+BaSO4D. 3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
科目:高中化學 來源: 題型:
【題目】已知七種短周期元素a~g的有關信息如下表所示:
元素編號 | a | b | c | d | e | f | g |
原子半徑/nm | 0.037 | 0.074 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
最高化合價或最低化合價 | +1 | ﹣2 | +3 | ﹣2 | +3 | +1 | +1 |
下列推斷不正確的是( )
A. 氫化物穩定性的強弱:b>dB. 金屬性的強弱:f<g
C. 元素e的氧化物只能與酸反應D. 元素a與元素d形成的化合物屬于共價化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某密閉容器中充入一定量SO2、O2發生反應2SO2(g)+O2(g)![]() 2SO3(g), 測得SO3濃度與反應溫度關系如圖.下列說法正確的是
2SO3(g), 測得SO3濃度與反應溫度關系如圖.下列說法正確的是

A. 該反應△H>0 B. SO2轉化率:a>b>c
C. 化學反應速率:c>b>a D. 平衡常數K:b>c>a
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗小組在同樣的實驗條件下,用同樣的實驗儀器和方法步驟進行兩組中和熱測定的實驗,實驗試劑及其用量如表所示。
反應物 | 起始溫度/℃ | 終了溫度/℃ | 中和熱/ kJ·mol-1 | |
硫酸 | 堿溶液 | |||
①0.5 mol·L-1 H2SO4溶液50 mL、1.1 mol·L-1 NaOH溶液50 mL | 25.1 | 25.1 | ΔH1 | |
②0.5 mol·L-1 H2SO4溶液50 mL、1.1 mol·L-1 NH3·H2O溶液50 mL | 25.1 | 25.1 | ΔH2 | |
(1)實驗①中堿液過量的目的是____________________。
(2)甲同學預計ΔH1≠ΔH2,其依據是______________________。
(3)若實驗測得①中終了溫度為31.8 ℃,則該反應的中和熱ΔH1=________(已知硫酸、NaOH溶液密度近似為1.0 g·cm-3,中和后混合液的比熱容c=4.18×10-3 kJ·g-1·℃-1)。
(4)在中和熱測定實驗中,若測定硫酸的溫度計未用水洗滌就直接測量堿溶液的溫度,則測得的中和熱ΔH________(填“偏大”“偏小”或“不變”,下同)。
(5)若實驗①中硫酸用鹽酸代替,且中和反應時有少量HCl揮發,則測得中和反應過程中放出的熱量Q________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,用0.l0mol/LKOH溶液滴定10.00mL 0.10mol/LH2C2O4(二元弱酸)溶液所得滴定曲線如圖(混合溶液的體積可看成混合前溶液的體積之和)。下列說法正確的是
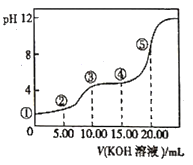
A. 點①所示溶液中![]() =1012
=1012
B. 點②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
C. 點③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D. 點④所示溶液中:c(K+)+ c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)=0.10mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了驗證木炭可被濃硫酸氧化成CO2,選用如圖所示裝置(內含物質)進行實驗。

(1)如按氣流由左向右的流向,連接如圖所示裝置的正確順序是_______(填字母)
(2)若實驗檢驗出有CO2生成,則裝置乙、丙中的現象分別為裝置乙中______,裝置丙中________。
(3)裝置丁中酸性KMnO4溶液的作用是________。
(4)寫出裝置甲中所發生反應的化學方程式:________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從海水中提取部分物質的過程如下圖所示

下列有關說法錯誤的是
A. 過程①需要加入化學試劑、沉淀、過濾等操作
B. 由“母液→無水MgCl2”一系列變化中未涉及氧化還原反應
C. 工業上一般用金屬鈉與無水MgCl2反應制取Mg單質
D. 反應③和⑤均可由下列反應實現:2Br-+Cl2=Br2+2Cl-,該反應屬于置換反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列事實不能用勒沙特列原理解釋的是
A. 濃度均為0.1 mol·L-1的新制氯水,加入少量NaHSO3晶體,片刻后,溶液中HClO分子的濃度減小
B. 室溫下,將1 mL pH=3的醋酸溶液加水稀釋至100 mL后,測得其pH<5
C. 在硫化氫水溶液中加入堿有利于S2—的生成
D. 增大壓強更利于合成氨反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在 2 L的密閉容器中, 充入 1 mol N2 和 3 mol H2, 在一定的條件下反應, 2 分鐘后達到平衡狀態, 相同溫度下, 測得平衡時混合氣體的壓強比反應前混合氣體的壓強減小了 1/10, 求:
(1) 平衡時混合氣體中三種氣體的物質的量比為多少______?
(2) N2 的轉化率為多少 _____?
(3) 該溫度下的平衡常數為多少_____ ?
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com