
【題目】碳、氮、氧、氯、鈉、銅等元素的化合物廣泛存在于自然界,回答下列問題:
(1)基態氯原子的價電子排布圖是________________________;基態銅原子核外電子占有的空間運動狀態有____________種
(2)碳、氮、氧三種元素中第一電離能最大的是____________ (填元素符號)CO32-中碳原子的雜化軌道類型為____________。
(3)相同條件下,水的沸點高于液氨,原因是________________________。
(4)銅與CNˉ可形成絡合離子[Cu(CNˉ)4]2-,寫出一種與CNˉ互為等電子體的分子的化學式____________;1 mol[ Cu(CNˉ)4]2-中含有____________molσ鍵;若將[Cu(CNˉ)4]2-中二個CNˉ換為Clˉ,只有一種結構,則[Cu(CNˉ)4]2-中4個氮原子所處空間位置關系為_________。
(5)氯化鈉的晶胞如圖所示。晶體中氯離子以面心立方最密堆積排列,鈉離子嵌入在氯離子之間的空隙中。一個氯離子周圍離氯離子最近的氯離子數目為__________個。已知:半徑r(Clˉ)=apm,r(Na+)=bpm。摩爾質量M(NaCI)=cg·mol-1則氯化鈉晶體的密度為_________g·cm-3

【答案】![]() 15 N sp2 氧元素的電負性大于氮,氧原子的半徑小于氮,水分子間氫鍵比氨分子間氫鍵強 N2或CO 8 正四面體 12
15 N sp2 氧元素的電負性大于氮,氧原子的半徑小于氮,水分子間氫鍵比氨分子間氫鍵強 N2或CO 8 正四面體 12 ![]() ×1030
×1030
【解析】
試題(1)基態氯原子的最外層有7個電子,排布在3s、3p能級上;銅原子核外有29個電子,核外電子排布為1s22s22p63s23p63d104s1;(2)同周期元素從左到右第一電離能增大,ⅤA族原子p軌道半充滿,第一電離能大于ⅥA族元素的原子;CO32-中碳原子的價電子對數是![]() ;(3) 水分子間氫鍵比氨分子間氫鍵強;(4)等電子體是原子數相同、價電子數相同的微粒;單鍵是σ鍵,三鍵中有1個是σ鍵;若將[Cu(CNˉ)4]2-中二個CNˉ換為Clˉ,只有一種結構,則[Cu(CNˉ)4]2-中4個氮原子所處空間位置關系為正四面體;(5)根據晶胞圖分析氯離子周圍離氯離子最近的氯離子數目;晶體中氯離子以面心立方最密堆積排列,鈉離子嵌入在氯離子之間的空隙中,r(Clˉ)=apm,所以晶胞邊長是
;(3) 水分子間氫鍵比氨分子間氫鍵強;(4)等電子體是原子數相同、價電子數相同的微粒;單鍵是σ鍵,三鍵中有1個是σ鍵;若將[Cu(CNˉ)4]2-中二個CNˉ換為Clˉ,只有一種結構,則[Cu(CNˉ)4]2-中4個氮原子所處空間位置關系為正四面體;(5)根據晶胞圖分析氯離子周圍離氯離子最近的氯離子數目;晶體中氯離子以面心立方最密堆積排列,鈉離子嵌入在氯離子之間的空隙中,r(Clˉ)=apm,所以晶胞邊長是![]() pm,根據均攤原則,每個晶胞含有 Clˉ數是
pm,根據均攤原則,每個晶胞含有 Clˉ數是![]() ,含有Na+數是
,含有Na+數是![]() ;
;
解析:(1)基態氯原子的價電子排布在3s、3p能級上,價電子排布圖是![]() ;銅原子核外有29個電子,核外電子排布為1s22s22p63s23p63d104s1,排布在15個原子軌道上,所以有15種空間運動狀態;(2)同周期元素從左到右第一電離能增大,ⅤA族原子p軌道半充滿,第一電離能大于ⅥA族元素的原子,所以碳、氮、氧三種元素中第一電離能最大的是N;CO32-中碳原子的價電子對數是
;銅原子核外有29個電子,核外電子排布為1s22s22p63s23p63d104s1,排布在15個原子軌道上,所以有15種空間運動狀態;(2)同周期元素從左到右第一電離能增大,ⅤA族原子p軌道半充滿,第一電離能大于ⅥA族元素的原子,所以碳、氮、氧三種元素中第一電離能最大的是N;CO32-中碳原子的價電子對數是![]() ,所以碳原子的雜化軌道類型為sp2 ;(3) 氧元素的電負性大于氮,氧原子的半徑小于氮,水分子間氫鍵比氨分子間氫鍵強,所以水的沸點高于液氨;(4)等電子體是原子數相同、價電子數相同的微粒,所以與CNˉ互為等電子體的分子的化學式是N2或CO;單鍵是σ鍵,三鍵中有1個是σ鍵,所以1 mol[ Cu(CNˉ)4]2-中含有8molσ鍵;若將[Cu(CNˉ)4]2-中二個CNˉ換為Clˉ,只有一種結構,則[Cu(CNˉ)4]2-中4個氮原子所處空間位置關系為正四面體;(5)根據晶胞圖,1個氯離子周圍離氯離子最近的氯離子數目是12個;晶體中氯離子以面心立方最密堆積排列,鈉離子嵌入在氯離子之間的空隙中,r(Clˉ)=apm,所以晶胞邊長是
,所以碳原子的雜化軌道類型為sp2 ;(3) 氧元素的電負性大于氮,氧原子的半徑小于氮,水分子間氫鍵比氨分子間氫鍵強,所以水的沸點高于液氨;(4)等電子體是原子數相同、價電子數相同的微粒,所以與CNˉ互為等電子體的分子的化學式是N2或CO;單鍵是σ鍵,三鍵中有1個是σ鍵,所以1 mol[ Cu(CNˉ)4]2-中含有8molσ鍵;若將[Cu(CNˉ)4]2-中二個CNˉ換為Clˉ,只有一種結構,則[Cu(CNˉ)4]2-中4個氮原子所處空間位置關系為正四面體;(5)根據晶胞圖,1個氯離子周圍離氯離子最近的氯離子數目是12個;晶體中氯離子以面心立方最密堆積排列,鈉離子嵌入在氯離子之間的空隙中,r(Clˉ)=apm,所以晶胞邊長是![]() pm,根據均攤原則,每個晶胞含有 Clˉ數是
pm,根據均攤原則,每個晶胞含有 Clˉ數是![]() ,含有Na+數是
,含有Na+數是![]() ;所以密度是
;所以密度是![]()
![]() ×1030 g·cm-3。
×1030 g·cm-3。


科目:高中化學 來源: 題型:
【題目】用50mL0.50mol/L鹽酸與50mL0.55mol/LNaOH溶液在如圖所示的裝置中進行中和反應。通過測定反應過程中所放出的熱量可計算中和熱。回答下列問題:
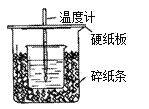
(1)從實驗裝置上看,圖中尚缺少的一種玻璃用品是________。
(2)燒杯間填滿碎紙條的作用是_______________________。
(3)大燒杯上如不蓋硬紙板,求得的中和熱數值__________(填“偏大、偏小、無影響”)。
(4)實驗中改用60 mL 0.50 mol·L-1的鹽酸跟50 mL 0.55 mol·L-1的NaOH溶液進行反應,與上述實驗相比,所放出的熱量_________(填“相等”或“不相等”),所求中和熱_____________ (填“相等”或“不相等”)。
(5)此反應中和熱的熱化學方程式為:________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質:①氫氧化鈉溶液、②銅片、③碳酸鈣、④蔗糖、⑤熔融的NaCl、⑥SO2氣體、⑦碳酸氫鈉、⑧鹽酸
(1)能導電且屬于電解質的是___________。(填編號)
(2)寫出碳酸鈣的電離方程式____________________________________。
(3)寫出碳酸氫鈉與氫氧化鈉反應的離子方程式____________________________________。
(4)向100mL1.5mol/L的氫氧化鈉溶液中緩慢通入一定量的CO2,反應后,向所得溶液中逐滴緩慢滴加一定濃度的鹽酸,所得氣體的體積與所加鹽酸的體積(不考慮氣體溶解于水)關系如圖所示。
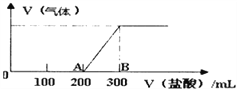
則
①氫氧化鈉溶液與一定量的CO2充分反應后的溶液中溶質為_________(寫化學式)。
②鹽酸的濃度為________________________。
③B點時,產生的氣體在標準狀況下的體積為_________________L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】右下表為元素周期表的一部分,其中X、Y、Z、W為短周期元素,W元素的核電荷數為X元素的2倍。下列說法正確的是( )
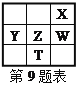
A. X、W、Z元素的原子半徑及它們的氣態氫化物的熱穩定性均依次遞增
B. Y、Z、W元素在自然界中均不能以游離態存在,它們的最高價氧化物的水化物的酸性依次遞增
C. YX2晶體熔化、液態WX3氣化均需克服分子間作用力
D. 根據元素周期律,可以推測T元素的單質具有半導體特性,T2X3具有氧化性和還原性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】隨原子序數的遞增,八種短周期元素(用字母X表示)原子半徑的相對大小、最高正價或最低負價的變化如下左圖所示,根據判斷出的元素回答問題:

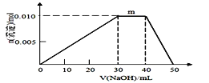
⑴ f在元素周期表的位置是__________。
⑵ 比較d、e常見離子的半徑的小(用化學式表示,下同)_______>__________比較g、h的最高價氧化物對應的水化物的酸性強弱是:_______>__________
⑶ 任選上述元素組成一種四原子共價化合物,寫出其電子式____________________
⑷ 已知1mole的單質在足量d2中燃燒,恢復至室溫,放出255.5kJ熱量,寫出該反應的熱化學方程式____________
⑸ 上述元素可組成鹽R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的燒杯中滴加1mol·L-1NaOH溶液,沉淀物質的量隨NaOH溶液體積變化示意圖如上右圖所示:
① R溶液中離子濃度由大到小的順序是________________
② 寫出m點反應的而離子方程式________________________________
③ 若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分中產生沉淀的物質的量為_______mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用廢舊鍍鋅鐵皮可制備磁性Fe3O4膠體粒子及副產物ZnO。制備流程圖如下:

已知:Zn及其化合物的性質與Al及其化合物的性質相似。請回答下列問題:
(1)用NaOH溶液處理廢舊鍍鋅鐵皮可以去除油污,還可以_____________。
(2)調節溶液A的pH可產生Zn(OH)2沉淀,為制得ZnO,后續操作步驟是____________→ 洗滌 →__________________。
(3)由溶液B制得Fe3O4膠體粒子的過程中,須持續通入N2,其原因是__________。
(4)用重鉻酸鉀法(一種氧化還原滴定法)可測定產物Fe3O4中的二價鐵含量。請寫出酸性條件下![]() 與
與![]() 反應的離子方程式______(
反應的離子方程式______(![]() 被還原為
被還原為![]() )。
)。
(5)若需配制濃度為0.010 00 mol·L-1的K2Cr2O7標準溶液250 mL,應準確稱取__________g ,K2Cr2O7(保留4位有效數字,已知M(K2Cr2O7)=294.0 g·mol-1)。配制該標準溶液時,下列儀器中不必要用到的有_______ (用編號表示)。
①電子天平 ②燒杯 ③錐形瓶 ④玻璃棒 ⑤250mL容量瓶 ⑥膠頭滴管 ⑦托盤天平
(6)若配制![]() 標準溶液時,俯視刻度線,則測定結果________(填“偏大”、“偏小”或“不變”,下同)。滴定操作中,如果滴定前裝有K2Cr2O7標準溶液的滴定管尖嘴部分有氣泡,而滴定結束后氣泡消失,則測定結果將_________ 。
標準溶液時,俯視刻度線,則測定結果________(填“偏大”、“偏小”或“不變”,下同)。滴定操作中,如果滴定前裝有K2Cr2O7標準溶液的滴定管尖嘴部分有氣泡,而滴定結束后氣泡消失,則測定結果將_________ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(15分)
A、B、D、E、F為短周期元素,非金屬元素A最外層電子數與其周期數相同,B的最外層電子數是其所在周期數的2倍。B 在D中充分燃燒能生成其最高價化合物BD2。E+與D2-具有相同的電子數。A在F中燃燒,產物溶于水得到一種強酸。回答下列問題:
(1)A在周期表中的位置是 ,寫出一種工業制備單質F的離子方程式 。
(2)B、D、E組成的一種鹽中,E的質量分數為43%,其俗名為 ,其水溶液與F單質反應的化學方程式為 ;在產物中加入少量KI,反應后加人CC14并振蕩,有 機層顯 色。
(3)由這些元素組成的物質,其組成和結構信息如下表:
物質 | 組成和結構信息 |
a | 含有A的二元離子化合物 |
b | 含有非極性共價鍵的二元離子化合物,且原子數之比為1:1 |
c | 化學組成為BDF2 |
d | 只存在一種類型作用力且可導電的單質晶體 |
a的化學式為 ;b的化學式為 ;;c的電子式為 ;
d的晶體類型是 。
(4)由A和B、D元素組成的兩種二元化合物形成一類新能源物質。一種化合物分子通過 鍵構成具有空腔的固體;另一種化合物(沼氣的主要成分)分子進入該空腔,其分子的空間結構為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列解釋事實的方程式不正確的是
A. 測0.1mol/L氨水的pH為11:NH3·H2O![]() NH
NH![]() +OH-
+OH-
B. 用Na2CO3處理水垢中CaSO4:CaSO4(s)+CO![]() (aq)
(aq)![]() SO
SO![]() (aq)+CaCO3(s)
(aq)+CaCO3(s)
C. 用CuCl2溶液做導電實驗,燈泡發光:CuCl2![]() Cu2++2Cl-
Cu2++2Cl-
D. 使用堿性電解質的氫氧燃料電池的正極反應式:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.某興趣學習小組設計如圖裝置制取SO2,研究其性質。
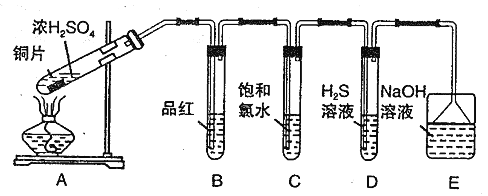
請回答下列問題:
(1)B、C、D分別用于檢驗SO2 的性質,寫出C中反應的離子方程式_______。
(2)實驗中觀察到D 中有渾濁出現,有同學提出此現象不能證明SO2 具有氧化性,請簡述理由________________________。
(3)E裝置的作用為______________。
II.某學習小組進一步探究不同濃度的硫酸氧化性不同,設計并完成如下實驗:
稱取一定量還原鐵粉放入一定體積濃硫酸中,加熱,充分反應后得到溶液X并收集到氣體Y。經檢驗,氣體Y 中含有SO2、H2。
(4)溶液X中含有的金屬陽離子是(填化學式)_________,簡述如何檢驗該離子______。
(5)為了測定氣體Y 中SO2 的含量,將2.24 L( 標準狀況)氣體Y 通入到200.00mL0.2000mol/L 酸性高錳酸鉀溶液中,充分反應后,取出20.00mL溶液轉入錐形瓶中進行滴定,消耗0.1000mol/L的KHC2O4標準液10.00mL (高錳酸鉀被還原均生成Mn2+ )。
①已知室溫下,0.1000mol/L KHC2O4 的溶液中,c(C2O42-) > c(H2C2O4)。滴定操作過程中標準液應用_______(填儀器名稱)盛裝;滴定終點的現象為____________。
②計算氣體Y 中SO2 的物質的量分數為__________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com