
(1)達到平衡時所需的時間A容器比B容器________,A容器中SO2的轉化率比B容器________。
(2)達到(1)所述平衡后,若向兩容器中通入數量不多的等量氬氣,A容器化學平衡________移動,B容器化學平衡________移動。
(3)達到(1)所述平衡時,若向兩容器中通入等量的原反應氣體,達到平衡時,A容器中SO3的體積分數比原平衡________,B容器中SO3的體積分數比原平衡________。
| (1)短,大
(2)逆向,不 (3)相等,大
|
| 提示:(1)A、B原本狀態相同,由于反應進行,混合氣體物質的量減少,A中活塞下滑以保持恒壓,而B中體積不變則壓強減小,繼續反應過程中,B是在小于A的壓強條件下進行,所以v(A) >v(B),到達平衡的時間t(A) <t(B)。依照增大壓強,平衡向該反應的正方向進行可知:A容器中SO2的轉化率大于B容器中SO2的轉化率。
(2)A中通入氬氣,總壓不變,活塞上移,對于反應氣體相當于減壓,平衡逆向移動,B容器中雖壓強增大,但反應氣體濃度未變,故平衡不移動。 (3)A中相當于兩個等同狀態的氣態平衡體系混合,活塞自動上移,平衡不移動,各組分的體積分數不變;而B中加入SO2和O2這些反應物,相當于加壓,平衡向正反應方向移動,SO3的體積分數增大。
|


科目:高中化學 來源: 題型:
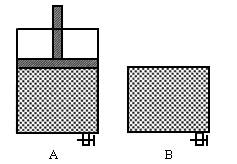
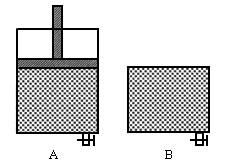
 有兩只密閉容器A和B,A容器有一個移動的活塞能使容器內保持恒壓,B容器能保持恒容.起始時間這兩只容器中分別充入等量的體積比為2:1的SO2和O2的混合氣體,并使A和B容積相等,如右圖.在保持400℃的條件下使之發生如下反應:2SO2+O2?2SO3.
有兩只密閉容器A和B,A容器有一個移動的活塞能使容器內保持恒壓,B容器能保持恒容.起始時間這兩只容器中分別充入等量的體積比為2:1的SO2和O2的混合氣體,并使A和B容積相等,如右圖.在保持400℃的條件下使之發生如下反應:2SO2+O2?2SO3.查看答案和解析>>
科目:高中化學 來源: 題型:
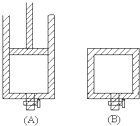
 有兩只密閉容器A和B,A容器有一個可以移動的活塞能使容器內保持恒壓,B容器能保持恒容.起始時向這兩個容器中分別充入等物質的量SO3氣體,并使A和B容積相等(如圖所示)在保持400℃的條件下使之發生如下反應:2SO2+O2
有兩只密閉容器A和B,A容器有一個可以移動的活塞能使容器內保持恒壓,B容器能保持恒容.起始時向這兩個容器中分別充入等物質的量SO3氣體,并使A和B容積相等(如圖所示)在保持400℃的條件下使之發生如下反應:2SO2+O2  2SO3.則下列描述正確的是( )
2SO3.則下列描述正確的是( )查看答案和解析>>
科目:高中化學 來源: 題型:022
如圖有兩只密閉容器A和B,A容器有一個移動的活塞使容器內保持恒壓,B容器能保持恒容,起始時向這兩只容器中分別充入等量的體積比為2∶1的SO2和O2的混合氣體,并使A和B容積相等。在保持400℃的條件下使之發生如下反應:2SO2+O2ƒ2SO3,填寫下列空格:
(1)達到平衡時所需的時間A容器比B容器________,A容器中SO2的轉化率比B容器________。
(2)達到(1)所述平衡后,若向兩容器中通入數量不多的等量氬氣,A容器化學平衡________移動,B容器化學平衡________移動。
(3)達到(1)所述平衡時,若向兩容器中通入等量的原反應氣體,達到平衡時,A容器中SO3的體積分數比原平衡________,B容器中SO3的體積分數比原平衡________。
查看答案和解析>>
科目:高中化學 來源: 題型:
(14分)(1)二氧化硫的催化氧化的過程如圖所示,其中a、c二步的化學方程式可表示為:
SO2+V2O5SO3+V2O4
4VOSO4+O22V2O5+4SO3。
該反應的催化劑是 (寫化學式)
(2)550 ℃時,SO2轉化為SO3的平衡轉化率(α)與體系總壓強(p)的關系如圖所示。將2.0 mol SO2和1.0 mol O2置于5 L密閉容器中,反應達平衡后,體系總壓強為0.10 M Pa。試計算反應2SO32SO2+O2 在550 ℃時的平衡常數K= 。
(3)550 ℃時,將2.0mol SO2和1.0 mol O2置于5L密閉容器中,反應達平衡后,下列措施中能使n(SO3)/n(SO2)增大的是
A.升高溫度 B.充入He(g),使體系總壓強增大
C.再充入2 mol SO2和1 mol O2 D.再充入1 mol SO2和1 mol O2
(4)維持溫度不變條件下使之發生如下反應:2SO2+O22SO3,有兩只密閉容器A和B。A容器有一個可以移動的活塞能使容器內保持恒壓,B容器能保持恒容。起始時向這兩個容器中分別充入等物質的量的體積比為2∶1的SO2和O2的混合氣體,并使A和B容積相等(如下圖所示)。
試填寫下列空格:
A容器達到平衡時所需的時間比B容器__ _(填:“短”或“長”);平衡時A容器中SO2的轉化率比B容器_______(填:“大”或“小”);達到所述平衡后,若向兩容器中通入等物質的量的原反應氣體,達到平衡時,A容器的混合氣體中SO3的體積分數_________(填“增大”、“減小”或“不變”,下同);B容器的混合氣體中SO3的體積分數_________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com