
【題目】NA表示阿伏加德羅常數的值。俗名為“臭堿”的硫化鈉廣泛應用千冶金染料、皮革等工業。硫化鈉的一種制備方法是Na2SO4+2C![]() Na2S+2CO2↑。下列有關說法正確的是( )
Na2S+2CO2↑。下列有關說法正確的是( )
A.12g石墨晶體中含有碳碳鍵的數目為3NA
B.1L0.1molL-1Na2S溶液中含陰離子的數目小于0.lNA
C.生成1mol氧化產物時轉移電子數為4NA
D.常溫常壓下,11.2LCO2中含質子的數目為11NA
科目:高中化學 來源: 題型:
【題目】下列熱化學方程式中,ΔH的絕對值表示可燃物的燃燒熱的是( ).
A.H2(g)+F2(g)=2HF(g) ΔH=-270 kJ/mol
B.CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=-802.3 kJ/mol
C.2H2(g)+O2(g)= 2H2O(l) ΔH=-571.6 kJ/mol
D.CO(g)+![]() O2(g)= CO2(g) ΔH=-283 kJ/mol
O2(g)= CO2(g) ΔH=-283 kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】t ℃時,pH=2的稀硫酸和pH=11的NaOH溶液等體積混合后溶液呈中性,則該溫度下,1體積的稀硫酸和10體積的NaOH溶液混合后溶液呈中性,則稀硫酸的pH(pHa)與NaOH溶液的pH(pHb)的關系是( )
A.pHa+pHb=12B.pHa+pHb=13C.pHa+pHb=14D.pHa+pHb=15
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)亞硝酰氯(ClNO)是有機合成中常用試劑,已知:2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0,一定溫度下,將2 molNO與2 molCl2置于2L密閉容器中發生反應。
2ClNO(g) △H<0,一定溫度下,將2 molNO與2 molCl2置于2L密閉容器中發生反應。
①下列可判斷反應達平衡狀態的是___________(填序號字母)。
A. 混合氣體的平均相對分子質量不變 B. 混合氣體密度保持不變
C. NO和Cl2的物質的量之比保持不變 D. 每消耗1 moI NO同時生成1molClNO
②為了加快化學反應速率,同時提高NO的轉化率,其他條件不變時,可采取的措施有_________(填選項序號字母)。
A. 升高溫度 B. 縮小容器體積 C. 再充入Cl2氣體 D. 使用合適的催化劑
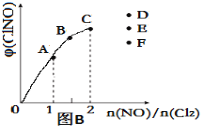
③一定條件下在恒溫恒容的密閉容器中,按一定比例充入NO(g)和Cl2(g),平衡時ClNO的體積分數隨n(NO)/n(Cl2)的變化圖像如圖(B)所示,當n(NO)/n(Cl2)=2.5時,達到平衡狀態,ClNO的體積分數可能是下圖中D、E、F三點中的________點。
(2) 在體積為10 L的密閉容器中充入3 mol NO和2 mol Cl2,在不同溫度下發生反應2NO(g)+Cl2(g)![]() 2ClNO(g),ClNO的百分含量隨時間的變化如圖所示。已知T1>T2>T3。
2ClNO(g),ClNO的百分含量隨時間的變化如圖所示。已知T1>T2>T3。
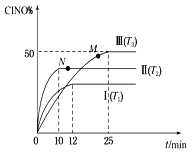
①與實驗Ⅰ相比,實驗Ⅱ除溫度不同外,還改變的條件是__________________。
②實驗Ⅲ反應至25 min達到平衡,用NO物質的濃度變化表示的反應速率為__________________。達到平衡時,若實驗Ⅲ達到平衡時的熱量變化為Q kJ,則該反應的熱化學方程式為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,向25ml氫氧化鈉標準溶液中逐滴加入0.2mol·L1的一元酸HA溶液,PH變化曲線如下圖所示:
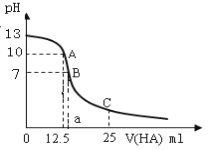
(1)該氫氧化鈉溶液的物質的量濃度為__________mol·L1。
(2)A點對應酸的體積為12.5ml,則所得混合溶液中由水電離出的c(OH)= _______mol·L1。
(3)HA是____酸(選填“強”、“弱”)。
(4) 在B點所得混合溶液中,c(Na+)、c(A)、c(H+)、c(OH) 的大小的順序是_____________。
(5)在C點所得混合溶液中,下列說正確的是________。
A.HA的電離程度小于NaA的水解程度
B.離子濃度由大到小的順序是c(Na+)>c(A)>c(H+)>c(OH)
C.c(Na+) + c(H+) = c(A-) + c(OH)
D.c(HA) + c(A) = 0.2mol·L1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】同一主族的X,Y,Z三種元素,已知其最高價含氧酸的鈉鹽溶液,等物質的量濃度時,溶液的pH大小為![]() ,則下列推斷正確的是
,則下列推斷正確的是
A.元素的非金屬性強弱![]() B.相對原子質量
B.相對原子質量![]()
C.陰離子的還原性![]() D.氣態氫化物穩定性
D.氣態氫化物穩定性![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年10月1曰,在慶祝中華人民共和國成立70周年的閱兵儀式上,最后亮相的DF-31A洲際戰略導彈是我國大國地位、國防實力的顯著標志。其制作材料中包含了Fe、Cr、Ni、C等多種元素。回答下列問題:
(1)基態Cr原子的價電子排布式為___。
(2)實驗室常用KSCN溶液、苯酚(![]() )檢驗Fe3+。
)檢驗Fe3+。
①第一電離能:N___O(填“>”或“<”)。
②1mol苯酚中含有的σ數目為___。
③苯酚中的氧原子和碳原子均采用相同的雜化方式,其類型為___。
④從結構的角度分析苯酚的酚羥基有弱酸性的原因為___。
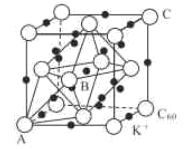
(3)碳的一種同素異形體的晶體可采取非最密堆積,然后在空隙中插入金屬離子獲得超導體。如圖為一種超導體的面心立方晶胞,C60分子占據頂點和面心處,K+占據的是C60分子圍成的___空隙和___空隙(填幾何空間構型);若C60分子的坐標參數分別為A(0,0,0),B(![]() ,0,
,0,![]() ),C(1,1,1)等,則距離A位置最近的陽離子的原子坐標參數為___。
),C(1,1,1)等,則距離A位置最近的陽離子的原子坐標參數為___。
(4)Ni可以形成多種氧化物,其中一種NiaO晶體晶胞結構為NaCl型,由于晶體缺陷,a的值為0.88,且晶體中的Ni分別為Ni2+、Ni3+,則晶體Ni2與Ni3+產的最簡整數比為___,晶胞參數為428pm,則晶體密度為___gcm-3(NA表示阿伏加德羅常數的值,列出表達式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質屬于分子晶體的是( )
A. 熔點是10.31℃,液態不導電,水溶液能導電
B. 熔點是1070℃,固態不導電,熔融狀態能導電,易溶于水
C. 熔點3550℃,不溶于水,不導電
D. 熔點是97.80℃,質軟,固態可導電,密度是0.97g·cm﹣3
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com