
【題目】烯烴復分解反應可示意如下:

利用上述方法制備核苷類抗病毒藥物的重要原料W的合成路線如下:

回答下列問題:
(1)B的化學名稱為____。
(2)由B到C的反應類型為____。
(3)D到E的反應方程式為____。
(4)化合物F在Grubbs II催化劑的作用下生成G和另一種烯烴,該烯烴的結構簡式是____。
(5)H中官能團的名稱是 ______.
(6)化合物X是H的同分異構體,可與FeCl3溶液發生顯色反應,1mol X最多可與3mol NaOH反應,其核磁共振氫譜為四組峰,峰面積比為3:2:2:1。寫出兩種符合要求的X的結構簡式:_____。
(7)由![]() 為起始原料制備
為起始原料制備 的合成路線如下,請補充完整(無機試劑任選)。
的合成路線如下,請補充完整(無機試劑任選)。
 _________________。
_________________。
【答案】丙烯醛 加成反應 ![]() CH2=CH2 羧基、碳碳雙鍵
CH2=CH2 羧基、碳碳雙鍵 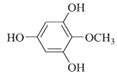 、
、

【解析】
(1)B為![]() ,其化學名稱為丙烯醛;
,其化學名稱為丙烯醛;
(2)由B到C是丙烯醛與水在磷酸及加熱條件下發生加成反應生成HOCH2CH2CHO,反應類型為加成反應;
(3)根據 ![]() 可知D到E為酯化反應,反應方程式為
可知D到E為酯化反應,反應方程式為![]() ;
;
(4)化合物F(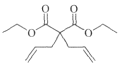 )在Grubbs II催化劑的作用下生成G(
)在Grubbs II催化劑的作用下生成G(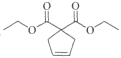 )和另一種烯烴,根據反應原理及碳原子數目可知,該烯烴為乙烯,結構簡式是CH2=CH2;
)和另一種烯烴,根據反應原理及碳原子數目可知,該烯烴為乙烯,結構簡式是CH2=CH2;
(5)根據G在氫氧化鉀溶液中加熱水解生成羧酸鉀和乙醇,再酸化得到羧酸H為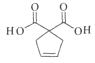 ,H中官能團的名稱是羧基、碳碳雙鍵;
,H中官能團的名稱是羧基、碳碳雙鍵;
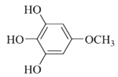
(6)化合物X是H的同分異構體,可與FeCl3溶液發生顯色反應,說明含有酚羥基,1mol X最多可與3mol NaOH反應,則含有三個酚羥基,其核磁共振氫譜為四組峰,峰面積比為3:2:2:1。符合要求的X的結構簡式有 、
、 ;
;
(7)由![]() 為起始原料制備
為起始原料制備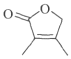 ,
,![]() 與氯化氫在催化劑及加熱條件下反應生成
與氯化氫在催化劑及加熱條件下反應生成![]() ,
,![]() 在酸性高錳酸鉀溶液中反應生成
在酸性高錳酸鉀溶液中反應生成![]() ,
,![]() 在氫氧化鈉的醇溶液中加熱發生消去反應生成
在氫氧化鈉的醇溶液中加熱發生消去反應生成![]() ,
,![]() 在稀硫酸作用下生成
在稀硫酸作用下生成![]() ,
,![]() 與
與![]() 發生酯化反應生成
發生酯化反應生成![]() ,
,![]() 在Grubbs II催化劑的作用下生成
在Grubbs II催化劑的作用下生成 ,合成路線如下:
,合成路線如下: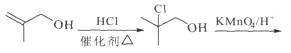
 。
。


 尖子生新課堂課時作業系列答案
尖子生新課堂課時作業系列答案 英才計劃同步課時高效訓練系列答案
英才計劃同步課時高效訓練系列答案科目:高中化學 來源: 題型:
【題目】下列說法中正確的是( )
A. CH4,C2H2,HCN都是含有極性鍵的非極性分子
B. CO2與SO2的立體構型相似,都是非極性分子
C. ![]() 分子中含有1個手性碳原子
分子中含有1個手性碳原子
D. 無機含氧酸分子中有幾個氫原子,它就屬于幾元酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】磺酰氯(SO2Cl2)主要用作氯化劑或氯磺化劑,也用于制造醫藥品、染料、表面活性劑等,熔、沸點分別為-54.1℃和69.2℃。

(1)SO2Cl2中S的化合價為______,SO2Cl2在潮濕空氣中發生劇烈反應,散發出具有刺激性和腐蝕性的“發煙”,該反應的化學方程式為____________________。
(2)擬用干燥的SO2和Cl2通入如圖裝置(省略夾持裝置)制取磺酰氯。
①儀器A的名稱為___________,通水方向為___________(填 “a→b”或“b→a”),裝置B的作用是___________。
②反應裝置中的活性炭的作用可能為:______________。
③若SO2和Cl2未經干燥,就通入裝置中,也散發出具有刺激性和腐蝕性的“發煙”,該反應的化學方程式為_________。
④滴定法測定磺酰氯的純度:取1.800g產品,加入到100mL0.5000mol·L1NaOH溶液中加熱充分水解,冷卻后加蒸餾水準確稀釋至250mL,取25mL溶液于錐形瓶中,滴加2滴甲基橙,用0.1000mol·L1標準HCl溶液滴定至終點,重復實驗三次取平均值,消耗10.00mL。 達到滴定終點的現象為___________,產品的純度為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25 ℃時,部分物質的電離常數如表所示:
化學式 | CH3COOH | H2CO3 |
電離常數 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 |
請回答下列問題:
(1)相同pH的CH3COONa、NaHCO3、Na2CO3濃度由大到小的順序為__________
(2)常溫下0.1mol·L-1的CH3COOH溶液在加水稀釋過程中,下列表達式的數據一定變小的是________(填字母,下同)。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(H+)/c(OH-)
(3)現有10mLpH=2的鹽酸溶液,進行以下操作:
a.與pH=5的鹽酸等體積混合,則pH=_____________;
b.向該鹽酸溶液中加入10mL0.02mol/LCH3COONa溶液,則該混合溶液中存在的物料守恒式為__________________;
c.向該鹽酸溶液中加入等體積等濃度的Na2CO3溶液,則混合溶液中存在的電荷守恒式為_______________________;
d. 下列關于體積都為10mL,pH=2的A(鹽酸)和B(CH3COOH)溶液說法正確的是_____ (填寫序號)。
①與等量的鋅反應開始反應時的速率A=B
②與等量的鋅反應(鋅完全溶解,沒有剩余)所需要的時間A>B
③加水稀釋100倍,pH大小比較:4=A>B>2
④物質的量濃度大小比較:A>B
⑤分別與10mLpH=12的NaOH溶液充分反應后的溶液pH大小比較:A<B
e. 現用標準HCl溶液滴定氨水,應選用________指示劑,下列操作會導致測定結果偏高的是___。
A.未用HCl標準溶液潤洗滴定管
B.滴定前錐形瓶內有少量水
C.滴定前滴定管尖嘴部分有氣泡,滴定后氣泡消失
D.觀察讀數時,滴定前仰視,滴定后俯視
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】巴豆酸的結構簡式為CH3-CH=CH-COOH。現有①氯化氫;②溴水;③純堿溶液;④丁醇;⑤酸性高錳酸鉀溶液。試根據巴豆酸的結構特點,判斷在一定條件下,能與巴豆酸反應的物質是
A.②④⑤B.①③④C.①②③④D.①②③④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述中,錯誤的是
A. 原子半徑:Na>Mg>O
B. 13C和14C屬于同位素
C. 0族元素是同周期中非金屬性最強的元素
D. N和P屬于第ⅤA族元素,HNO3酸性比H3PO4的強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有NaCl、Na2SO4和NaNO3的混合物,選擇適當的試劑除去雜質,從而得到純凈的NaNO3晶體,相應的實驗流程如圖所示。

請回答下列問題:
(1)寫出實驗流程中下列物質的化學式:試劑X____。
(2)上述實驗流程中①②③步均要進行的實驗操作是____(填操作名稱)。
(3)上述實驗流程中加入過量Na2CO3溶液的目的是____________。
(4)按此實驗方案得到的溶液3中肯定含有雜質。為了解決這個問題,可以向溶液3中加入適量的________(填化學式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.I A族元素均是堿金屬元素.
B.第VIA族元素隨原子序數的增大,其對應的最簡單氫化物的還原性逐漸增強
C.氯的氧化物對應水化物的酸性一定強于碳酸的酸性
D.同周期從左到右主族元素對應單質的熔、沸點依次降低
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com