
【題目】為了能觀察到丁達爾效應,一中鼴鼠科學社的同學在實驗室制備Fe(OH)3膠體。
(1)膠體與其他分散系的本質區別是:__。
(2)制備時,將_逐滴滴加至_中,待液體呈_后,停止加熱;反應方程式為__。
(3)有一種橘紅色的硫化銻(Sb2S3)膠體,裝入U型管,插入電極后通直流電,發現陽極附近橘紅色加深,這叫__現象,證明Sb2S3膠粒帶__電荷。
(4)如何設計實驗驗證制得的氫氧化鐵是膠體:__。
【答案】分散質粒子直徑大小 飽和氯化鐵溶液 沸水 紅褐 FeCl3+3H2O![]() Fe(OH)3+3HCl 電泳 負 用可見光束照射膠體和溶液,出現光亮的通道的是膠體
Fe(OH)3+3HCl 電泳 負 用可見光束照射膠體和溶液,出現光亮的通道的是膠體
【解析】
(1)膠體分散系與其它分散系的本質差別是分散質直徑的大小不同分析判斷;
(2)氫氧化鐵膠體制備方法是向沸水中滴入飽和氯化鐵溶液加熱至紅褐色;
(3)膠體具有電泳現象,證明膠體微粒吸附帶電離子;
(4)膠體具有丁達爾效應。
(1)當分散劑是水或其它溶液時,根據分散質粒子直徑大小來分類,把分散系劃分為:溶液(小于1nm)、膠體(1nm-100nm)、濁液(大于100nm);所以溶液、膠體和濁液這三種分散系的本質的區別在于分散質粒子直徑大小;因此,本題正確答案是:分散質粒子直徑大小。
(2)實驗室制備氫氧化鐵膠體是在沸騰的蒸餾水中加入飽和氯化鐵溶液,當溶液變為紅褐色時立即停止加熱,反應的化學方程式為: FeCl3+3H2O![]() Fe(OH)3+3HCl;
Fe(OH)3+3HCl;
因此,正確答案是:飽和氯化鐵溶液,沸水,紅褐,FeCl3+3H2O![]() Fe(OH)3+3HCl。
Fe(OH)3+3HCl。
(3)有一種橘紅色的硫化銻(Sb2S3)膠體,裝入U型管,插入電極后通直流電,發現陽極附近橘紅色加深,說明膠體微粒吸附的是負電荷,此現象是膠體的電泳現象;
因此,本題正確答案是:電泳,負。
(4)可以用可見光束照射膠體和溶液,若出現光亮的通道的是膠體,否則是溶液;
因此,本題正確答案是:用可見光束照射膠體和溶液,出現光亮的通道的是膠體。


 沖刺100分1號卷系列答案
沖刺100分1號卷系列答案科目:高中化學 來源: 題型:
【題目】實施以節約能源和減少廢氣排放為基本內容的節能減排政策,是應對全球氣候問題、建設資源節約型、環境友好型社會的必然選擇。試運用所學知識,回答下列問題:
(1)已知在一定溫度下,①C(s)+CO2(g) ![]() 2CO(g) △H1=a kJ/mol 平衡常數K1;
2CO(g) △H1=a kJ/mol 平衡常數K1;
②CO(g)+H2O(g) ![]() H2(g)+CO2(g) △H2=b kJ/mol 平衡常數K2;
H2(g)+CO2(g) △H2=b kJ/mol 平衡常數K2;
某反應的平衡常數表達式K3=![]() ,請寫出此反應的熱化學方程式:__________,K1、K2、K3之間的關系是:_____________。
,請寫出此反應的熱化學方程式:__________,K1、K2、K3之間的關系是:_____________。
(2)將原料氣按n(CO2):n(H2)=1:4置于密閉容器中發生CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)反應,測得H2O(g)的物質的量分數與溫度的關系如圖所示
CH4(g)+2H2O(g)反應,測得H2O(g)的物質的量分數與溫度的關系如圖所示
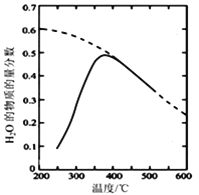 (虛線表示平衡曲線)。
(虛線表示平衡曲線)。
①該反應的平衡常數K隨溫度降低而________(填“增大”或“減小”)。
②在密閉恒溫(高于100℃)恒容裝置中進行該反應,下列能說明達到平衡狀態的是_____。
A.混合氣體密度不再改變
B.混合氣體壓強不再改變
C.混合氣體平均摩爾質量不再改變
D. n(CO2):n(H2)=1:2
③200℃達到平衡時體系的總壓強為p,該反應平衡常數Kp的計算表達式為______。(不必化簡,用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)
(3)500℃時,CO與水反應生成CO2和H2。將CO2和H2分離得到H2的過程示意圖如下。
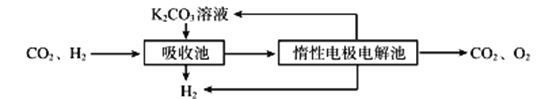
①吸收池中所有離子濃度的等式關系是____________________________。
②結合電極反應式,簡述K2CO3溶液的再生原理:___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】龍癸醛是一種珍貴香料,廣泛應用于香料、醫藥、染料及農藥等行業。其合成路線如圖所示(部分反應產物和反應條件已略去)。

回答下列問題:
(1)下列有關R和烯烴C3H6的說法正確的是__________________。(填代號)
A.它們的實驗式相同 B.它們都能使溴水褪色
C.它們都能發生加成反應 D.它們都含有碳碳雙鍵
(2)反應⑤的試劑和條件是___________________________;反應③的類型是_____________________。
(3)T所含官能團的名稱是________;反應④的化學方程式為__________________________________。
(4)X的名稱是____________________。
(5)遇氯化鐵溶液發生顯色反應的T的同分異構體有________種,其中,在核磁共振氫譜上有4組峰且峰面積比為1∶2∶3∶6的結構簡式為_______________________________________________。
(6)參照上述流程圖,以2—甲基—1,3—丁二烯為原料,經三步制備2—甲基—1,4—丁二醛,設計合成路線:________________________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲烷在鎳催化作用下可與水反應制合成氣(CO和H2),再制成甲醇代替燃油。
(1)CH4和H2O所含的三種元素電負性從小到大的順序為________。
(2)CH4和CO2分子中碳原子的雜化類型分別是_____和_______。
(3)基態Ni原子的電子排布式為______,該元素位于元素周期表的第_____族。
(4)金屬鎳粉在CO氣流中輕微加熱,生成無色揮發性液態Ni(CO)4,該分子呈正四面體構型。則1molNi(CO)4中含有____molσ鍵,Ni(CO)4的晶體類型為_____,Ni(CO)4易溶于下列___(填選項字母)中。
a.水 b.四氧化碳 C.苯 d.硫酸鎳溶液
(5)如圖是一種鎳鑭合金儲氫后的晶胞結構示意圖。該合金中原子個數比La:Ni=_____,儲氫后,含1molLa的合金可吸附H2的數目為______。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關物質用途的說法中,不正確的是
A.液氨可以作制冷劑
B.濃硫酸具有吸水性,可用于干燥氨氣
C.二氧化硫可以漂白某些有色物質
D.氨和硝酸都能用于制造化肥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應“P4(s)+3NaOH(aq)+3H2O(l)=3NaH2PO2(aq)+PH3(g) ΔH>0”制得的NaH2PO2可用于化學鍍鎳。下列說法正確的是

A. P4分子中P原子均滿足8電子穩定結構
B. 反應中NaOH作還原劑
C. 該反應能自發進行,則ΔS<0
D. 反應中生成1 mol NaH2PO2,轉移電子數目為3×6.02×1023
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在3個體積均為1 L的恒容密閉容器中發生反應:SO2(g)+2NO(g)![]() 2NO2(g)+S(s)。改變容器I的反應溫度,平衡時c( NO2)與溫度的關系如下圖所示。下列說法正確的是
2NO2(g)+S(s)。改變容器I的反應溫度,平衡時c( NO2)與溫度的關系如下圖所示。下列說法正確的是
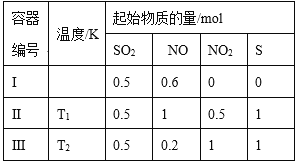
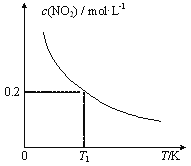
A. 該反應的ΔH<0
B. T1時,該反應的平衡常數為![]()
C. 容器Ⅰ與容器Ⅱ均在T1時達到平衡,總壓強之比小于1:2
D. 若T2<T1,達到平衡時,容器Ⅲ中NO的體積分數小于40%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關能量轉化的認識不正確的是( )
A.通過植物的光合作用,太陽能轉化為化學能
B.人類使用照明設備,將電能轉化為光能
C.生物體內的化學變化過程,在能量轉化上比在體外發生的一些能量轉化更為合理有效
D.燃料燃燒,只是將化學能轉化為熱能
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com