
 (2012?濟南一模)(1)水的電離平衡曲線如圖所示,若A點表示25℃時水的電離達平衡時的離子濃度,B點表示100°C時水的電離達平衡時的離子濃度.100℃時1mol?L-1 的NaOH溶液中,由水電離出的c(H+)=
(2012?濟南一模)(1)水的電離平衡曲線如圖所示,若A點表示25℃時水的電離達平衡時的離子濃度,B點表示100°C時水的電離達平衡時的離子濃度.100℃時1mol?L-1 的NaOH溶液中,由水電離出的c(H+)=| 化學式 | 電離常數(25℃) |
| HCN | K=4.9×l0-10 |
| CH3COOH | K=1.8×l0-5 |
| H2CO3 | K1=4.3×l0-7、K2=5.6×l0-11 |


科目:高中化學 來源: 題型:
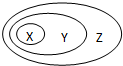 (2012?濟南一模)下表所列物質或概念間的從屬關系符合如圖所示關系的是( ) (2012?濟南一模)下表所列物質或概念間的從屬關系符合如圖所示關系的是( )
|
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com