
分析 A、B、C、D四種元素的原子序數依次遞增,A、B元素的基態原子L電子層中末成對電子數分別為3、2,則A原子核外電子排布式為1s22s22p3,A為氮元素;B的原子序數大于氮元素,則B原子核外電子排布式為1s22s22p4,B為氧元素;短周期主族元素中C元素的電負性最小,則C為Na元素;D元素被稱為繼鐵、鋁之后的第三金屬,其合金多用于航天工業,被譽為“21世紀的金屬”,其基態原子外圍電子占據兩個能級且各能級電子數相等,則D為Ti元素,結合元素周期率以及題目要求解答該題.
解答 解:(1)氮元素原子2p能級容納3個電子,為半滿穩定狀態,能量較低,第一電離能高于同周期相鄰元素,結合金屬性越強第一電離能越小,則第一電離能由小到大的順序是Na<O<N,故答案為:Na<O<N;
(2)D為Ti元素,核外電子排布式為[Ar]3d24s2,故答案為:[Ar]3d24s2;
(3)該白色晶體為Na3NO4,NO43-離子中N原子價層電子對數=4+$\frac{5+3-2×4}{2}$=4,N原子沒有孤對電子,故其為正四面體結構,N原子采取sp3雜化,
故答案為:正四面體;sp3;
(4)A2B為N2O,價電子為16,含有3個原子,則對應的等電子體為CO2 或CS2,故答案為:CO2 或CS2;
(5)Ti3+的配位數均為6,往待測溶液中滴入AgNO3溶液,均產生白色沉淀,則有氯離子在配合物的外界,兩份沉淀,經洗滌干燥后稱量,發現原綠色晶體的水溶液與AgNO3溶液反應得到的白色沉淀質量為紫色晶體的水溶液反應得到沉淀質量的$\frac{2}{3}$,可知紫色晶體中含3個氯離子,綠色晶體中含2個氯離子,即綠色晶體的化學式為[TiCl(H2O)5]Cl2•H2O,含有離子鍵、極性鍵、配位鍵,
故答案為:[TiCl(H2O)5]Cl2•H2O;abd.
點評 本題物質結構與性質,為高考常見題型,題目涉及核外電子排布、電離能、雜化軌道與微粒結構、等電子體、配合物等,推斷元素是解題關鍵,注意掌握等電子體的概念,注意配合物中內界離子與外界離子的區別,難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化學反應速率:4v正(O2)=5v逆(NO) | |
| B. | NH3、O2、NO、H2O的分子個數比是4:5:4:6 | |
| C. | 單位時間內生成4 mol NO的同時消耗6 mol H2O | |
| D. | 反應混合物中NH3的體積分數不再改變 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
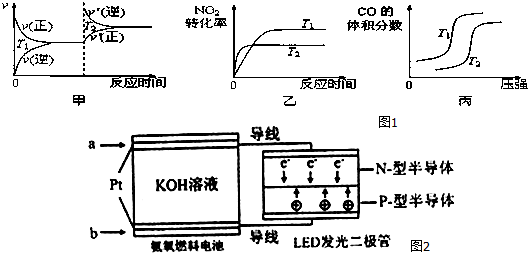
時間/min 濃度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 以NaCl等為原料制備KClO4的過程如下:
以NaCl等為原料制備KClO4的過程如下:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
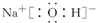 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
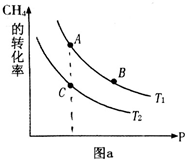 氫氣、甲醇是優質的清潔燃料,可制作燃料電池.
氫氣、甲醇是優質的清潔燃料,可制作燃料電池.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 化學式 | H2(g) | CO(g) | CH3OH(l) |
| 標準燃燒熱(25℃) △H/kJ•mol-1 | -285.8 | -283.0 | -726.5 |
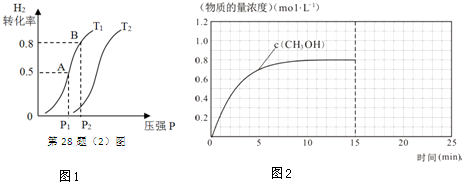
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol H2中含有6.02×1023個H | B. | 1 mol氧含有6.02×1023個O2 | ||
| C. | 1 mol CaCl2溶液里含有1 mol離子 | D. | 1 mol H+中含有H+數為NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com