
| 物質 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
| 開始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 |
| 難溶物質 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | NiS | CoS |
| pKsp | 38.55 | 15.26 | 14.7 | 18.49 | 20.40 |
| 3 |
| ||
| ||
| ||


科目:高中化學 來源: 題型:
| A、標準狀況下,11.2L乙烯含有的極性共價鍵數為NA |
| B、常溫下,5.6LNO和5.6LO2的混合氣體中含有的分子數為0.5NA |
| C、16.9gBaO2固體中陰、陽離子總數為0.2NA. |
| D、常溫常壓下,28g氮氣含有的核外電子數為10 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:
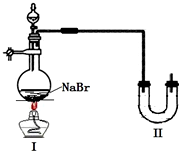 某學校同學進行乙醇的化學性質實驗探究學習,以下為他們的學習過程.
某學校同學進行乙醇的化學性質實驗探究學習,以下為他們的學習過程.
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
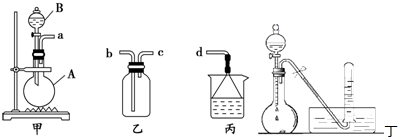
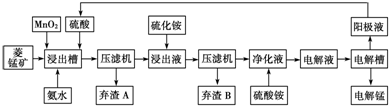
查看答案和解析>>
科目:高中化學 來源: 題型:
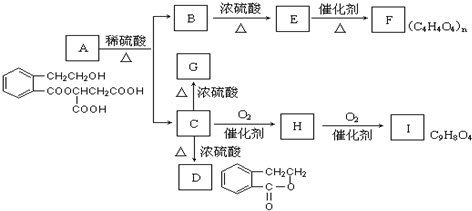
查看答案和解析>>
科目:高中化學 來源: 題型:
| 實驗操作 | 實驗現象或預期試驗先行 | 現象解釋(用離子方程式表示) | ||
| 猜想② | (1) | 溶液PH=8 | --- | |
| 向PH=2的硫酸中滴加Na2S2O3溶液 | (2) | S2O
| ||
| 猜想③ | 向新制氯水(PH<2)中滴加少許Na2S2O3溶液 | 氯水顏色變淺 | (3) |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com