
【題目】鋁鎂合金已成為飛機制造、化工生產等行業的重要材料。研究性學習小組的同學,為測定某含鎂3%~5%的鋁鎂合金(不含其它元素)中鎂的質量分數,設計下列兩種不同實驗方案進行探究。填寫下列空白。
[方案一]
〖實驗方案〗將鋁鎂合金與足量NaOH溶液反應,測定剩余固體質量。
(1)實驗中發生反應的化學方程式是___________________________。
(2)稱取5.4g鋁鎂合金粉末樣品,溶于V mL 2.0 mol/L NaOH溶液中。為使其反應完全,則NaOH溶液的體積V ≥ ______________。過濾、洗滌、干燥、稱量固體。該步驟中若未洗滌固體,測得鎂的質量分數將_________(填“偏高”、“偏低”或“無影響”)。
[方案二]
〖實驗方案〗將鋁鎂合金與足量稀硫酸溶液反應,測定生成氣體在通常狀況(約20℃,1.01![]() 105Pa)的體積。
105Pa)的體積。
〖問題討論〗(3)同學們擬選用圖一實驗裝置完成實驗:

①你認為最簡易的裝置其連接順序是:A接(____)(_____)接(____)( )接( )(填接口字母,可不填滿。)②實驗開始時,先打開分液漏斗上口的玻璃塞,再輕輕打開分液漏斗可旋轉的活塞,一會兒后稀硫酸也不能順利滴入錐形瓶中。請你幫助分析原因_________________________。
③實驗結束時,在讀取測量實驗中生成氫氣的體積時,你認為最合理的是__________。(有幾個選幾個)。
A.等待實驗裝置冷卻后再讀數
B.上下移動量筒F,使其中液面與廣口瓶中液面相平
C.上下移動量筒G,使其中液面與廣口瓶中液面相平
D.視線與凹液面的最低點水平,讀取量筒中水的體積
(4)仔細分析實驗裝置后,同學們經討論認為以下兩點會引起較大誤差:稀硫酸滴入錐形瓶中,即使不生成氫氣,也會將瓶內空氣排出,使所測氫氣體積偏大;實驗結束時,連接廣口瓶和量筒的導管中有少量水存在,使所測氫氣體積偏小。于是他們設計了圖二的實驗裝置。

①裝置中導管a的作用是_________________________。
②實驗前后堿式滴定管中液面讀數分別為V1 mL、V2 mL。則產生氫氣的體積為_________mL。(用含V1、V2的式子表達)
【答案】 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 97mL 偏高 E D G 鎂、鋁與稀硫酸反應放熱且生成氣體,使錐形瓶中氣體壓強變大 ACD 使分液漏斗內氣體壓強與錐形瓶內氣體壓強相等,打開分液漏斗活塞時稀硫酸能順利滴下,滴入錐形瓶的稀硫酸體積等于進入分液漏斗的氣體體積,從而消除由于加入稀硫酸引起的氫氣體積誤差 V1-V2
【解析】方案一:⑴.鋁與氫氧化鈉溶液反應生成偏鋁酸鈉與氫氣,反應方程式為:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案為:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
⑵.含鎂為3%時,金屬鋁的含量最高,5.4g合金中鋁的質量為5.4g×(13%)=5.4×97% g,則:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
54g 2mol
5.4g×97% g V×103L×2.0mol/L
得54g:(5.4g×97% g)=2mol:(V×103L×2.0mol/L),解得V=97,NaOH溶液的體積97mL;鎂上會附著偏鋁酸鈉等物質,若未洗滌固體,會導致測定鎂的質量偏大,鎂的質量分數偏高;
故答案為:97mL;偏高;
方案二:⑶.①.合金與稀硫酸反應,用排水量氣法測定氫氣的體積,其中盛水的試劑瓶導管一定要短進長出,利用增大壓強原理將水排出,量筒中水的體積就是生成氫氣的體積,量筒內導管應伸入量筒底部,故連接順序為:(A)接(E)、(D)接(G);
故答案為:E、D、G;
②.鎂、鋁與稀硫酸反應放熱且生成氣體,使錐形瓶中氣體壓強變大,導致硫酸不能順利滴入錐形瓶;故答案為:鎂、鋁與稀硫酸反應放熱且生成氣體,使錐形瓶中氣體壓強變大;
③.反應放熱導致氫氣的溫度偏高,故應冷卻后再進行讀取氫氣的體積,讀取實驗中生成氫氣的體積時上下移動量筒,使其中液面與廣口瓶中液面相平,視線與凹液面的最低點水平讀取氫氣的體積;
故答案選ACD;
⑷.①.裝置中導管a的作用是:保持分液漏斗內氣體壓強與錐形瓶內氣體壓強相等,打開分液漏斗活塞時稀硫酸能順利滴下,滴入錐形瓶的稀硫酸體積等于進入分液漏斗的氣體體積,從而消除由于加入稀硫酸引起的氫氣體積誤差,故答案為:使分液漏斗內氣體壓強與錐形瓶內氣體壓強相等,打開分液漏斗活塞時稀硫酸能順利滴下,滴入錐形瓶的稀硫酸體積等于進入分液漏斗的氣體體積,從而消除由于加入稀硫酸引起的氫氣體積誤差;
②.滴定管的0刻度在上方,兩次讀取的體積數值之差為測定的氫氣的體積,收集氫氣后滴定管內液面上升,讀數減小,所以測定氫氣的體積為V1V2,故答案為:V1V2。


科目:高中化學 來源: 題型:
【題目】下列關于化學電源的說法正確的是( )
A. 干電池放電之后還能再充電
B. 充電電池在放電和充電時都將化學能轉化為電能
C. 充電電池可以無限制地反復放電、充電
D. 氫氧燃料電池是一種環境友好型電池
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 含有共價鍵的化合物一定是共價化合物
B. KI和HI中化學鍵類型完全相同
C. Na2O2中既含有離子鍵又含有非極性共價鍵
D. KOH中只含有共價鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】羰基硫(COS)可作為一種糧食熏蒸劑,能防止某些昆蟲、線蟲和真菌的危害.在恒容密閉容器中,將CO和H2S混合加熱并達到下列平衡: CO(g)+H2S(g)COS(g)+H2(g) K=0.1
反應前CO的物質的量為10mol,平衡后CO物質的量為8mol,下列說法正確的是( )
A.升高溫度,H2S濃度增加,表明該反應是吸熱反應
B.通入CO后,正反應速率逐漸增大
C.反應前H2S物質的量為7mol
D.CO的平衡轉化率為80%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA表示阿伏加德羅常數的值,下列說法正確的是( ) 
A.5.6 g鐵粉在0.1mol氯氣中充分燃燒,轉移電子數為0.3NA
B.12.5mL 16molL﹣1濃硫酸與足量銅反應,轉移電子數為0.2NA
C.7.8g Na2S和Na2O2的混合物中含有的陰離子數等于0.1NA
D.0.5mol雄黃(As4S4 , 結構如圖)含有NA個S﹣S鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲、乙兩個小組利用酸性KMnO4與H2C2O4溶液反應,設計實驗探究影響反應速率的因素(2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2+8H2O) 甲組:利用如圖裝置,通過測定單位時間內生成CO2氣體體積的大小來比較化學反應速率的大小.(實驗中所用KMnO4溶液均已加入H2SO4)
序號 | A溶液 | B溶液 |
① | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
② | 2ml 0.1mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
③ | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液和少量MnSO4 |
(1)該實驗的目的是探究對化學反應速率的影響.
(2)分液漏斗中A溶液應該加入(填“一次性”或“逐滴滴加”)
(3)實驗結束后,讀數前為了使兩個量氣管的壓強相等,避免產生壓強差,影響測定結果,需要進行的操作是 . 乙組:通過測定KMnO4溶液褪色所需時間的多少來比較化學反應速率為了探究KMnO4與H2C2O4濃度對反應速率的影響,某同學在室溫下完成以下實驗
實驗編號 | 1 | 2 | 3 | 4 |
水/ml | 10 | 5 | 0 | X |
0.5mol/L H2C2O4/ml | 5 | 10 | 10 | 5 |
0.2mol/L KMnO4/ml | 5 | 5 | 10 | 10 |
時間/s | 40 | 20 | 10 | ﹣﹣﹣ |
(4)X= A.5 B.10 C.15 D.20
4號實驗中始終沒有觀察到溶液褪色,你認為可能的原因是 . 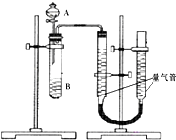
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數,下列敘述正確的是( )
A. 64 g SO2含有氧原子數為1NA
B. 物質的量濃度為0.5 mol·L-1的MgCl2溶液,含有Cl-數為1 NA
C. 標準狀況下,22.4 L H2O的分子數為1NA
D. 常溫常壓下,14 g N2含有分子數為0.5 NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于乙酸性質的敘述中,錯誤的是
A. 乙酸的酸性比碳酸強,所以它可以與碳酸鹽反應,產生CO2氣體
B. 乙酸能與醇類物質發生酯化反應
C. 乙酸分子中含有碳氧雙鍵,所以它能使溴水褪色
D. 乙酸在溫度低于16.6 ℃時,就凝結成冰狀晶體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定條件下可實現如圖所示的物質之間的變化:

據此回答下列問題:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中對于溶液和沉淀的分離采取的方法是_____.
(2)根據上述框圖反應關系,寫出下列B、C、D、E所含物質的化學式
沉淀固體B______;C________;沉淀D_____;溶液E________.
(3)寫出①、②、③、④四個反應方程式
①_________________________;
②________________________;
③________________________;
④________________________.
【答案】 過濾 Al2O3 Al2O3、Fe2O3 Fe2O3 K2SO4、(NH4)2SO4 Al2O3+2NaOH+3H2O=2Na[Al(OH)4] 2KAl(SO4)2+6 NH3.H2O=K2SO4+3(NH4)2SO4+2Al(OH)3↓ Na[Al(OH)4]+HCl=NaCl+H2O+Al(OH)3↓ 2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
【解析】KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀C為Al2O3和Fe2O3;由轉化關系圖可知,向沉淀C中加NaOH溶液,Fe2O3不反應,沉淀D為Fe2O3,Al2O3可與NaOH溶液反應生成NaAlO2,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀,Al(OH)3受熱分解生成固體B為Al2O3;向溶液中加過量氨水,溶液與過量氨水反應,Al3+被沉淀,得到氫氧化鋁沉淀,溶液中E為K2SO4、(NH4)2SO4,經過蒸發、結晶,得到K2SO4和(NH4)2SO4;
(1)溶液和沉淀的分離利用過濾;
(2)由上述分析可知B為Al2O3,C為Al2O3、Fe2O3,D為Fe2O3溶液E為K2SO4、(NH4)2SO4;
(3)反應①為Al2O3+2NaOH+3H2O=2Na[Al(OH)4],
反應②為2KAl(SO4)2+6NH3.H2O=K2SO4+3(NH4)2SO4+2Al(OH)3↓,
反應③為Na[Al(OH)4]+HCl=NaCl+H2O+Al(OH)3↓,
反應④為2Al(OH)3![]() Al2O3+3H2O。
Al2O3+3H2O。
點睛:考查無機物的推斷,綜合考查元素化合物性質,側重Al、Fe及其化合物性質的考查,注意氧化鋁的兩性,明確發生的化學反應為解答的關鍵,由轉化關系圖可知,向沉淀C中加NaOH溶液,Fe2O3不反應,沉淀D為Fe2O3,Al2O3可與NaOH溶液反應生成NaAlO2,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀,Al(OH)3受熱分解生成固體B為Al2O3;向溶液中加過量氨水,溶液與過量氨水反應,Al3+被沉淀,得到氫氧化鋁沉淀,溶液中E為K2SO4、(NH4)2SO4,經過蒸發、結晶,得到K2SO4和(NH4)2SO4,然后結合物質的性質及化學用語來解答。
【題型】填空題
【結束】
26
【題目】在常溫下,Fe與水并不發生反應,但在高溫下,Fe與水蒸氣可發生反應。應用如圖所示裝置,在硬質玻璃管中放入還原鐵粉和石棉絨的混合物,加熱,并通入水蒸氣,就可以完成高溫下Fe與水蒸氣反應的實驗。

請回答該實驗中的問題。
(1)寫出Fe與水蒸氣反應的化學方程式:____________________________________。
(2)實驗前必須對整套裝置進行的操作是__________________________。
(3)圓底燒瓶中盛裝的是水,該裝置受熱后的主要作用是_________________________。
(4)干燥管中盛裝的物質可以是________________,作用是_______________。
(5)試管中收集到的氣體,若要在處玻璃管口處點燃該氣體,則必須對該氣體進行__________,目的是:____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com