
科目:高中化學 來源: 題型:
有飽和一元脂肪酸和飽和一元脂肪醇形成的酯A.已知:①燃燒2.2gA可生成4.4gCO2和1.8g水;②1.76gA和50mL0.5 mol·L-1的氫氧化鈉溶液共熱后,為中和剩余的堿液,耗去0.2 mol·L-1的鹽酸25mL;③取A水解后所得的醇0.64g,跟足量鈉反應時,放出224mLH2(標準狀況).求:
(1)A的相對分子質量、分子式、結構簡式。
(2)寫出下列反應的化學方程式:
①A+NaOH![]()
②A水解生成的醇+Na→
③A+O2![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
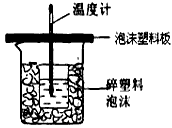
Ⅰ.(4分)用50mL0.50mol/L鹽酸與50mL0.55mol/LNaOH溶液在如圖所示的裝置中進行中和反應。通過測定反應過程中所放出的熱量可計算中和熱。回答下列問題:
(1)從實驗裝置上看,圖中尚缺少的一種玻璃用品 是 。
(2)用相同濃度和體積的氨水(NH3·H2O)代替NaOH溶液進行上述實驗,測得的中和熱的數值會 ;(填“偏大”、“偏小”、“無影響”)。
(3)如果反應前后的溫度差是(t2-t1),鹽酸、氫氧化鈉溶液的密度均為1g/cm3,比熱容為4.18J/(g•℃),寫出該實驗中和熱的計算式:△H=
Ⅱ.(12分)影響化學反應速率的因素很多,某校化學小組用實驗的方法進行探究。
實驗一:他們只利用Cu、Fe、Mg和不同濃度的硫酸(0.5 mol/L、2 mol/L、18.4 mol/L)。設計實驗方案來研究影響反應速率的因素。
甲同學研究的實驗報告如下表:
| 實驗步驟 | 現象 | 結論 |
| ①分別取等體積的2 mol/L的硫酸于試管中 | 反應速率Mg>Fe,Cu不反應 | 金屬的性質越活潑,反應速率越快 |
| ②___________________ |
(1)甲同學表中實驗步驟②為____________________________________________。
(2)甲同學的實驗目的是______________________________________;要得出正確的實驗結論,還需控制的實驗條件是________。
乙同學為了更精確的研究濃度對反應速率的影響,利用下圖所示裝置進行定量實驗。
(3)乙同學在實驗中應該測定的數據是______________。
(4)乙同學完成該實驗應選用的實驗藥品是___________。
該實驗中不選用某濃度的硫酸,理由是____________。
查看答案和解析>>
科目:高中化學 來源:2014屆云南省昆明市高二9月月考化學試卷(解析版) 題型:實驗題
(共6分)實驗室用50 mL 0.50 mol·L-1鹽酸、50 mL 0.55 mol·L-1 NaOH溶液和如圖所示裝置,進行測定中和熱的實驗,得到表中的數據:

|
實驗次數 |
起始溫度t1/℃ |
終止溫度t2/℃ |
|
|
鹽酸 |
NaOH溶液 |
||
|
1 |
20.2 |
20.3 |
23.7 |
|
2 |
20.3 |
20.5 |
23.8 |
|
3 |
21.5 |
21.6 |
24.9 |
完成下列問題:
(1)實驗時不能用銅絲攪拌棒代替環形玻璃攪拌棒的理由是 。
(2)在操作正確的前提下,提高中和熱測定準確性的關鍵是 。
(3)根據上表中所測數據進行計算,則該實驗測得的中和熱ΔH= [鹽酸和NaOH溶液的密度按1 g·cm-3計算,反應后混合溶液的比熱容(c)按4.18 J·(g·℃)-1計算]。如用0.5 mol/L的鹽酸與NaOH固體進行實驗,則實驗中測得的“中和熱”數值將 (填“偏大”、“偏小”、 “不變”)。
(4)若某同學利用上述裝置做實驗,有些操作不規范,造成測得中和熱的數值偏低,請你分析可能的原因是
A.測量鹽酸的溫度后,溫度計沒有用水沖洗干凈
B.把量筒中的氫氧化鈉溶液倒入小燒杯時動作遲緩
C.做本實驗的當天室溫較高
D.將50mL0.55mol/L氫氧化鈉溶液取成了50mL0.55mol/L的氨水
E.在量取鹽酸時仰視計數
F.大燒杯的蓋板中間小孔太大
查看答案和解析>>
科目:高中化學 來源:山東省模擬題 題型:單選題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com