
【題目】無機物轉化題。A、B、C、D都是中學化學中常見物質,其中A、B、C均含有同一種元素,在一定條件下相互轉化關系如下(部分反應中的水已略去)。根據題意回答下列問題:
(1)若A、B、C的焰色反應均為黃色,C為廚房中的用品,D的過度排放會造成溫室效應。
①A的化學式______________,B的俗名____________;
②反應Ⅱ的離子方程式是_____________。
(2)若A、D均為單質,且A為氣體,D元素的一種紅棕色氧化物常用作顏料。
①反應Ⅱ的離子方程式是____________;
②反應Ⅲ的離子方程式表示反應__________;
③檢驗B中陽離子最好的試劑是_________(寫化學式)。
(3)C與NaOH溶液反應,用離子方程式表示產生此現象的過程________、_____。
【答案】NaOH 純堿或蘇打 CO32-+CO2+H2O==2HCO3- 2Fe3++Fe=3Fe2+ 2Fe2++Cl2==2Fe3++2Cl- KSCN Fe2++2OH-==Fe(OH)2↓ 4Fe(OH)2+O2+2H2O==4Fe(OH)3
【解析】
(1)若A、B、C的焰色反應均為黃色,則含鈉元素;C為廚房中的用品,則C 為NaHCO3;D的過度排放會造成溫室效應,則D為CO2。
①采用逆推法,可確定A、B;
②反應Ⅱ為碳酸鈉與二氧化碳及水的反應。
(2)若A、D均為單質,且A為氣體,D元素的一種紅棕色氧化物常用作顏料,則D為Fe,則A為Cl2。
①反應Ⅱ為氯化鐵與鐵反應;
②反應Ⅲ為氯氣與氯化亞鐵反應;
③檢驗B中陽離子,即檢驗Fe3+,最好的試劑是硫氰化鉀。
(3)氯化亞鐵與NaOH溶液反應,先發生復分解反應,后發生氧化反應。
(1)由以上分析,可確定A、B、C中都含鈉元素,C 為NaHCO3,D為CO2。
①采用逆推法,可確定B為Na2CO3,則A為NaOH,B的俗名為純堿或蘇打;
答案為:NaOH;純堿或蘇打;
②反應Ⅱ為碳酸鈉與二氧化碳及水的反應,離子方程式為CO32-+CO2+H2O==2HCO3-;
答案為:CO32-+CO2+H2O==2HCO3-;
(2)若A、D均為單質,且A為氣體,D元素的一種紅棕色氧化物常用作顏料,則D為Fe,則A為Cl2,則B為FeCl3,C為FeCl2。
①反應Ⅱ為氯化鐵與鐵反應,離子方程式是2Fe3++Fe=3Fe2+;答案為:2Fe3++Fe=3Fe2+;
②反應Ⅲ為氯氣與氯化亞鐵反應,離子方程式是2Fe2++Cl2==2Fe3++2Cl-;
答案為:2Fe2++Cl2==2Fe3++2Cl-;
③檢驗B中陽離子,即檢驗Fe3+,由于鐵離子與硫氰化鉀溶液相遇,溶液變為血紅色,因此檢驗鐵離子的最好試劑是KSCN;
答案為:KSCN;
(3)氯化亞鐵與NaOH溶液反應,先發生復分解反應,后發生氧化反應,方程式為Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+O2+2H2O==4Fe(OH)3;
答案為:Fe2++2OH-=Fe(OH)2↓;4Fe(OH)2+O2+2H2O==4Fe(OH)3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】下列是某興趣小組根據課本實驗設計的一個能說明Na2CO3與NaHCO3熱穩定性的套管實驗。請觀察下圖的實驗裝置、分析實驗原理,下列說法錯誤的是( )

A. 甲為小蘇打,乙為純堿
B. 要證明NaHCO3受熱能產生水,可在小試管內塞上沾有無水硫酸銅粉末的棉花球
C. 整個實驗過程中可以看到丙燒杯的澄清石灰水沒變渾濁
D. 同質量的甲和乙分別與足量的鹽酸完全反應,產生二氧化碳的質量:乙>甲
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究![]() 等大氣污染氣體的處理具有重要意義。
等大氣污染氣體的處理具有重要意義。
(1)已知:![]() ;
;![]() ;
;
則反應![]() 的
的![]() =________。
=________。
(2)一定條件下,將![]() 與
與![]() 以體積比
以體積比![]() 置于密閉容器中發生上述反應,測得上述反應平衡時
置于密閉容器中發生上述反應,測得上述反應平衡時![]() 與
與![]() 體積比為
體積比為![]() ,則平衡常數
,則平衡常數![]() =________(保留兩位小數)。
=________(保留兩位小數)。
(3)![]() 可用于合成甲醇,反應方程式為
可用于合成甲醇,反應方程式為![]() 。
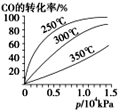
。![]() 在不同溫度下的平衡轉化率與壓強的關系如圖所示。該反應
在不同溫度下的平衡轉化率與壓強的關系如圖所示。該反應![]() ________
________![]() (填“>”或“<”)。實際生產條件控制在
(填“>”或“<”)。實際生產條件控制在![]() 、
、![]() 左右,選擇此壓強的理由是__________________。
左右,選擇此壓強的理由是__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I。草酸(H2C2O4)與高錳酸鉀在酸性條件下能夠發生反應:
(實驗1)甲同學用8.00 mL 0.001 mol/L KMnO4溶液與5.00 mL 0.01 mol/L H2C2O4溶液反應,研究不同條件對化學反應速率的影響。改變的條件如下:
組別 | KMnO4溶液 /mL | H2C2O4溶液 /mL | 10%硫酸體積/mL | 溫度/℃ | 其他物質 |
Ⅰ | 8.00 | 5.00 | 3.00 | 20 | |
Ⅱ | 8.00 | 5.00 | 3.00 | 30 | |
Ⅲ | 8.00 | 5.00 | 1.00 | 20 | 2.00 mL蒸餾水 |
(1)寫出草酸(H2C2O4)與高錳酸鉀溶液在酸性條件下反應的離子方程式________。
(2)上述進行實驗Ⅰ、Ⅲ的目的是探究__________對化學反應速率的影響。
(實驗2)乙同學在研究草酸與高錳酸鉀在酸性條件下反應的影響因素時發現,草酸與酸性高錳酸鉀溶液開始一段時間反應速率較慢,溶液褪色不明顯,但不久后突然褪色,反應速率明顯加快。
(3)針對上述現象,乙同學認為草酸與高錳酸鉀反應放熱,導致溶液溫度升高,反應速率加快。從影響化學反應速率的因素看,你猜想還可能是_______的影響。
(4)若用實驗證明你的猜想,除了酸性高錳酸鉀溶液和草酸溶液外,還需要選擇的試劑最合理的是____(填字母)。
a.硫酸鉀 b.水 c.二氧化錳 d.硫酸錳
Ⅱ.用如圖所示的裝置進行中和熱的測定實驗,分別取![]() 的
的![]() 溶液、
溶液、![]() 的硫酸進行實驗,回答下列問題:
的硫酸進行實驗,回答下列問題:
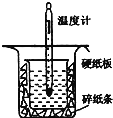
(1)從上圖實驗裝置看,其中尚缺少的一種玻璃用品是__________,除此之外,裝置中的一個明顯錯誤是__________。
(2)近似認為![]() 的NaOH溶液和
的NaOH溶液和![]() 的硫酸溶液的密度都是
的硫酸溶液的密度都是![]() ,中和后生成溶液的比熱容
,中和后生成溶液的比熱容![]() ,通過以下數據計算中和熱△H=__________(結果保留小數點后一位)。
,通過以下數據計算中和熱△H=__________(結果保留小數點后一位)。
溫度 實驗次數 | 起始溫度t1/℃ | 終止溫度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
2 | 27.0 | 27.4 | 27.2 | 32.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
4 | 26.4 | 26.2 | 26.3 | 29.8 |
(3)上述實驗數值結果與![]() 有偏差,產生偏差的原因可能是(填字母)_____。
有偏差,產生偏差的原因可能是(填字母)_____。
a.實驗裝置保溫、隔熱效果差
b.用溫度計測定![]() 溶液起始溫度后直接測定H2SO4溶液的溫度
溶液起始溫度后直接測定H2SO4溶液的溫度
c.分多次把![]() 溶液倒入盛有硫酸的小燒杯中
溶液倒入盛有硫酸的小燒杯中
d.將以上四實驗測量溫度均納入計算平均值
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,下列各組離子在指定溶液中能大量共存的是( )
A.pH=2的溶液:Na+、Fe2+、I-、NO3-
B.c(AlO2-)=0.1 mol·L-1的溶液:K+、Na+、OH-、SO42-
C.![]() =0.1 mol·L-1的溶液:Na+、NH4+、SiO32-、ClO-
=0.1 mol·L-1的溶液:Na+、NH4+、SiO32-、ClO-
D.c(Fe3+)=0.1 mol·L-1的溶液:Mg2+、NH4+、Cl-、SCN-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將物質X逐漸加入Y溶液中,生成沉淀物質的量n2與所加X的物質的量n1的關系如圖所示。符合圖所示情況的是
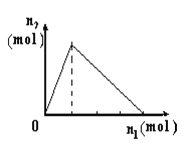
A | B | C | D | |
X | NaOH | AlCl3 | HCl | NaAlO2 |
Y | AlCl3 | NaOH | NaAlO2 | HCl |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碘是人體必需的微量元素之一,我國以前在食鹽中加KI加工碘鹽。
(1) 目前加碘食鹽中,不用KI的主要原因是__________________________。
(2) 將Fe3I8加入到K2CO3溶液中,生成Fe3O4、KI和一種氣體,該反應的化學方程式為__________。
(3) 準確稱取某KI樣品3.500 0 g配制成100.00 mL溶液;取25.00 mL所配溶液置于錐形瓶中,加入15.00 mL 0.100 0 mol·L-1 K2Cr2O7酸性溶液(Cr2O72-轉化為Cr3+),充分反應后,煮沸除去生成的I2;冷卻后加入過量KI,用0.200 0 mol·L-1 Na2S2O3標準溶液滴定至終點(I2和S2O32-反應生成I-和S4O62-),消耗Na2S2O3標準溶液24.00 mL。計算該樣品中KI的質量分數____________ (寫出計算過程)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電解法處理CO2和SO2的混合氣體的原理如圖所示,電解質為熔融碳酸鹽和硫酸鹽,通電一段時間后,Ni電極表面形成摻雜硫的碳積層。下列說法錯誤的是( )
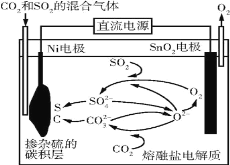
A.Ni電極表面發生了還原反應
B.陽極的電極反應為2O2--4e-=O2↑
C.電解質中發生的離子反應只有2SO2+O2+2O2-=2SO![]()
D.該過程實現了電解質中熔融碳酸鹽和硫酸鹽的自主補充循環
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】C、N的氧化物常會造成一些環境問題,科研工作者用各種化學方法來消除這些物質對環境的影響。回答下列問題:
(1)CO2的重整:用CO2和H2為原料可得到CH4燃料。
已知:①![]()
②![]()
寫出CO2重整的熱化學方程式___________________________。
200℃時,向VL恒溫密閉容器A(恒容)、B(恒壓)中,均充入1molCO2和4molH2,兩容器中反應達平衡時放出或吸收的熱量較多的是_________________(填“A”或“B”)。
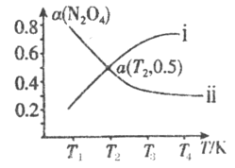
(2)在恒容密閉容器中充入一定量的N2O4,發生可逆反應![]() 。則N2O4的平衡轉化率隨溫度的變化曲線為右圖中的______________(填“i”或“ⅱ”)曲線。若T2K時容器的起始壓強為102kPa,則該溫度下反應的分壓平衡常數Kp=_____________kPa。
。則N2O4的平衡轉化率隨溫度的變化曲線為右圖中的______________(填“i”或“ⅱ”)曲線。若T2K時容器的起始壓強為102kPa,則該溫度下反應的分壓平衡常數Kp=_____________kPa。
(3)反應![]() ,在一定條件下,N2O4與NO2的消耗速率與各自的分壓有如下關系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是與溫度有關的常數,相應的速率與N2O4或NO2的分壓關系如右圖所示。在T℃時,圖中M,N點能表示該反應達到平衡狀態,理由是__________________________________。改變溫度,v(NO2)會由M點變為A,B或C,v(N2O4)會由N點變為D,E或F,當升高到某一溫度時,反應重新達到平衡,相應的點分別為____________(填字母標號)。
,在一定條件下,N2O4與NO2的消耗速率與各自的分壓有如下關系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是與溫度有關的常數,相應的速率與N2O4或NO2的分壓關系如右圖所示。在T℃時,圖中M,N點能表示該反應達到平衡狀態,理由是__________________________________。改變溫度,v(NO2)會由M點變為A,B或C,v(N2O4)會由N點變為D,E或F,當升高到某一溫度時,反應重新達到平衡,相應的點分別為____________(填字母標號)。

(4)間接電化學法除NO,其原理如圖所示。寫出陰極的電極反應式(陰極室溶液呈酸性)_____________________,吸收池中除去NO的原理_______________(用離子方程式表示)。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com