
【題目】銅與濃硫酸在如圖所示裝置中發生反應,實驗中觀察到的現象為![]() 試管中溶液變為綠色,試管底部出現黑色和灰白色沉淀;
試管中溶液變為綠色,試管底部出現黑色和灰白色沉淀;![]() 試管中先出現氣泡,短時間內品紅溶液無變化,之后溶液的紅色逐漸變淺直至褪去。試回答下列問題:
試管中先出現氣泡,短時間內品紅溶液無變化,之后溶液的紅色逐漸變淺直至褪去。試回答下列問題:
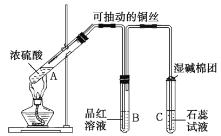
(1)![]() 試管中發生反應的化學方程式為______。
試管中發生反應的化學方程式為______。
(2)![]() 試管中先出現的氣泡為______(填名稱)。
試管中先出現的氣泡為______(填名稱)。
(3)實驗完畢后取下![]() 試管,______,若溶液______,可證明使品紅溶液褪色的物質為
試管,______,若溶液______,可證明使品紅溶液褪色的物質為![]() 。
。
(4)![]() 試管中的現象是______。
試管中的現象是______。
(5)濕堿棉團的作用是______。
(6)實驗完畢后,待溶液冷卻后,取![]() 試管中上層清液加入水中,發現溶液溫度升高。試解釋溶液溫度升高的原因:____________。
試管中上層清液加入水中,發現溶液溫度升高。試解釋溶液溫度升高的原因:____________。
(7)將反應后的沉淀加入水中,黑色沉淀不溶解,灰白色沉淀大部分溶解,溶液變為藍色,則灰白色沉淀的主要成分為____________。
(8)黑色沉淀可能為![]() 、
、![]() 或
或![]() ,根據所學知識,設計實驗驗證黑色沉淀中是否含有
,根據所學知識,設計實驗驗證黑色沉淀中是否含有![]() (已知
(已知![]() 、
、![]() 均為黑色固體,不溶于水和稀硫酸):____________。
均為黑色固體,不溶于水和稀硫酸):____________。
【答案】![]() (濃)
(濃)![]() 空氣 加熱 恢復紅色 紫色石蕊試液變紅 吸收
空氣 加熱 恢復紅色 紫色石蕊試液變紅 吸收![]() 尾氣,防止污染環境 反應物中濃硫酸過量,加水稀釋時放出大量的熱,使溶液溫度升高
尾氣,防止污染環境 反應物中濃硫酸過量,加水稀釋時放出大量的熱,使溶液溫度升高 ![]() 取少量黑色沉淀加入稀硫酸,若溶液變藍,則黑色沉淀中含有
取少量黑色沉淀加入稀硫酸,若溶液變藍,則黑色沉淀中含有![]() ,若溶液不變藍,則黑色沉淀中不含
,若溶液不變藍,則黑色沉淀中不含![]()
【解析】
銅與濃硫酸反應生成CuSO4和SO2,可抽動的銅絲,可以控制反應的發生和停止,SO2能使品紅溶液褪色,SO2溶于水生成H2SO3,使石蕊溶液呈紅色,蘸有堿溶液的棉團用于尾氣吸收。
(1)A試管中,銅與濃硫酸在加熱條件下反應生成硫酸銅、二氧化硫和水,化學方程式為![]() (濃)
(濃) ![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)裝置中有空氣存在,故B試管中先出現的氣泡為空氣;
(3)二氧化硫具有漂白性,其與某些有色物質生成的無色物質不穩定,則加熱后品紅溶液恢復紅色,故實驗完畢后取下B試管,加熱,若溶液恢復紅色,可證明使品紅溶液褪色的物質為![]() ;
;
(4)二氧化硫與水反應生成亞硫酸,能使紫色石蕊試液變紅;
(5)二氧化硫氣體有毒,能被堿液吸收,故濕堿棉團的作用是吸收![]() 尾氣,防止污染環境;
尾氣,防止污染環境;
(6)反應物中濃硫酸過量,故取上層清液加水稀釋時,放出大量的熱,使溶液溫度升高;
(7)根據題給信息推斷,灰白色沉淀的主要成分為CuSO4;
(8)![]() 與稀硫酸反應生成硫酸銅和水,根據題給信息知
與稀硫酸反應生成硫酸銅和水,根據題給信息知![]() 、
、![]() 與稀硫酸不反應,則驗證黑色沉淀中是否含有
與稀硫酸不反應,則驗證黑色沉淀中是否含有![]() 的實驗方案為:取少量黑色沉淀加入稀硫酸,若溶液變藍,則黑色沉淀中含有
的實驗方案為:取少量黑色沉淀加入稀硫酸,若溶液變藍,則黑色沉淀中含有![]() ,若溶液不變藍,則黑色沉淀中不含
,若溶液不變藍,則黑色沉淀中不含![]() 。
。


 53隨堂測系列答案
53隨堂測系列答案科目:高中化學 來源: 題型:
【題目】南海是一個巨大的資源寶庫,開發利用這些資源是科學研究的重要課題。如圖為海水資源利用的部分過程,有關說法不正確的是( )
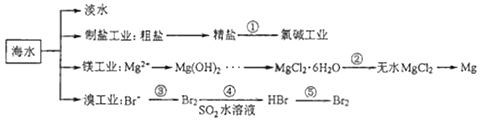
A.海水淡化的方法主要有蒸餾法、電滲析法
B.氯堿工業中采用陰離子交換膜可提高產品的純度
C.由MgCl2·6H2O得到無水MgCl2要在HCl的氣流中加熱
D.溴工業中③、④的目的是為了富集溴元素,溴元素在反應③、⑤中均被氧化,在反應④中被還原
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】等質量的兩份鋅粉a和b,分別加入過量的稀硫酸中,a中同時加入少量CuSO4溶液,下列圖中表示其產生H2的總體積(V)與時間(t)的關系正確的是( )
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是![]() 與濃硫酸反應的實驗裝置。已知:銅片足量,濃硫酸(濃度為
與濃硫酸反應的實驗裝置。已知:銅片足量,濃硫酸(濃度為![]() )為
)為![]() 。下列有關判斷正確的是( )
。下列有關判斷正確的是( )
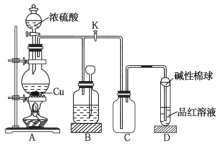
A.裝置![]() 中盛裝的是濃硫酸,作用是干燥
中盛裝的是濃硫酸,作用是干燥![]()
B.裝置![]() 為安全瓶,防止裝置
為安全瓶,防止裝置![]() 中的液體倒吸入裝置
中的液體倒吸入裝置![]() 中
中
C.品紅溶液可檢驗生成的![]() ,堿性棉球的作用是吸收空氣中的酸性氣體
,堿性棉球的作用是吸收空氣中的酸性氣體
D.裝置![]() 的作用是收集
的作用是收集![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向50mL0.01mol·L-1的HA溶液中逐滴加入0.01mol·L-1的MOH溶液,混合溶液pH的變化與所加MOH溶液的體積關系如圖所示(密度引起的體積變化忽略不計),下列說法正確的是( )
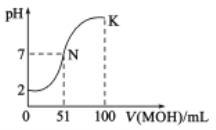
A.由圖無法判斷HA是強酸還是弱酸
B.混合溶液的pH=7時,HA與MOH恰好完全反應
C.K點對應的溶液中,c(M+)>c(OH-)>c(A-)>c(H+)
D.當加入MOH溶液的體積為50mL時,溶液中:c(H+)=c(MOH)+c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有一塊鐵的“氧化物”樣品,用140mL 5.0mol·L-1鹽酸恰好將之完全溶解,所得溶液還能吸收0.025mol Cl2,恰好使其中的Fe2+全部轉變為Fe3+,則該樣品可能的化學式為
A. Fe2O3B. Fe3O4C. Fe4O5D. Fe5O7
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某菱錳礦的主要成分為MnCO3,還含有少量的FeCO3、CaCO3、MgCO3、Al2O3以及一些不反應的不溶性雜質,工業上以菱錳礦為原料制備高純度碳酸錳的流程如圖所示:

已知:MnCO3+2NH4Cl![]() MnCl2+CO2↑+2NH3↑+H2O
MnCl2+CO2↑+2NH3↑+H2O
相關金屬離子[c0(Xn+)=0.1mol·L-1]形成氫氧化物沉淀的pH范圍如下:
金屬離子 | Mn2+ | Fe2+ | Ca2+ | Mg2+ | Al3+ | Fe3+ |
開始沉淀時的pH | 8.1 | 6.3 | 10.6 | 8.9 | 3.4 | 1.5 |
完全沉淀時的pH | 10.1 | 8.3 | 13.1 | 10.9 | 4.7 | 2.8 |
(1)焙燒爐中生成的氣體A的成分有__(填化學式)。
(2)氣體A可用于制取純堿,其制取過程如圖所示:
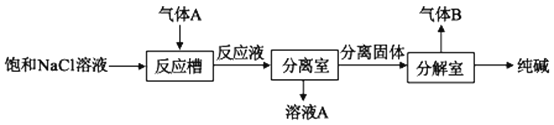
反應槽中有沉淀產生,該沉淀是__(填化學式),生成該沉淀的離子反應方程式為___,氣體B的化學式為___。
(3)凈化室中的除雜包含三步:
①加入少量MnO2將Fe2+轉化為Fe3+,其反應的離子方程式為___;
②加氨水調pH=5.6,生成的沉淀的化學式是__;
③加入適量NH4F,將作為雜質的剩余金屬陽離子轉化為難溶于水的沉淀除去。
(4)凈化液中含有的離子主要有__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用下圖所示裝置制備KClO溶液,再用KClO溶液與KOH、Fe(NO3)3溶液反應制備高效凈水劑K2FeO4。
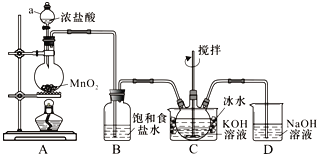
已知:Cl2與KOH溶液在20℃以下反應生成KClO,在較高溫度下則生成KClO3;K2FeO4易溶于水、微溶于濃KOH溶液,在0℃~5℃的強堿性溶液中較穩定。
回答下列問題:
(1)儀器a的名稱___________,裝置C中三頸瓶置于冰水浴中的目的是______________________。
(2)裝置B吸收的氣體是____________(寫化學式),裝置D的作用是____________________。
(3)裝置C中得到足量KClO后,將三頸瓶上的導管取下,依次加入KOH溶液、Fe(NO3)3溶液,控制水浴溫度為25℃,攪拌1.5 h,溶液變為紫紅色(含K2FeO4),反應的離子方程式為____________________。再加入飽和KOH溶液,析出紫黑色晶體,過濾,得到K2FeO4粗產品。
(4)K2FeO4粗產品含有Fe(OH)3、KCl等雜質,其提純方法為:將一定量的K2FeO4粗產品溶于冷的3 mol·L-1KOH溶液中,過濾,將盛有濾液的燒杯置于冰水浴中,向其中加入________________,攪拌、靜置、過濾,用乙醇洗滌固體2~3次,最后將固體放在真空干燥箱中干燥。
(5)測定K2FeO4產品純度。稱取K2FeO4產品0.2100 g于燒杯中,加入足量的強堿性亞鉻酸鹽溶液,反應后再加稀硫酸調節溶液呈強酸性,配成250 mL溶液,取出25.00 mL放入錐形瓶,用0.01000 mol·L-1的(NH4)2Fe(SO4)2溶液滴定至終點,重復操作2次,平均消耗標準溶液30.00 mL[已知:Cr(OH)4-+FeO42-=Fe(OH)3↓+CrO42-+OH-,2CrO42-+2H+=Cr2O72-+H2O,Cr2O72-+6Fe2++14H+=6Fe3++3Cr3++7H2O]。則K2FeO4產品的純度為_________ %(保留1位小數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化氯是一種黃綠色具有刺激性氣味的氣體,常用于自來水消毒和果蔬保鮮等方面。氯酸鈉還原法是目前使用較為廣泛的ClO2制備方法,其中一種是用NaClO3與CH3OH在催化劑、60℃時,發生反應得到ClO2,下圖裝置(夾持裝置略)對其制備、吸收、釋放進行了研究。
已知:
①ClO2的濃度較大時易分解,實驗室用穩定劑吸收ClO2,生成NaClO2,使用時加酸只釋放出ClO2種氣體;
②ClO2與KI反應的離子方程式為:2ClO2+10I+8H+2Cl+5I2+4H2O。
③![]()

請回答:
(1) 儀器b在裝置中的作用是________;比較儀器c和d,實驗中c的優點是________。
(2) 制備裝置甲中需改進的一項措施是________。
(3) 反應中甲醇被氧化為甲酸,寫出制備ClO2的化學方程式:________;該制備法可選用不同的還原性物質作為還原劑,例如草酸,相比甲醇法,草酸法的優點是________。
(4) 下列有關說法正確的是________。
A.儀器a中NaOH溶液主要用于停止反應,并吸收多余的ClO2
B.裝置e主要用于檢驗是否有Cl2生成
C.在ClO2釋放實驗中,發生的離子反應方程式是:4H++5ClO=Cl+4ClO2↑+2H2O
D.ClO2和Cl2都為強氧化劑,在相同條件下,等物質的量時,Cl2的氧化能力是ClO2的2.5倍
(5) 自來水廠用碘量法檢測水中ClO2的濃度,其實驗操作如下:取100.0 mL的水樣,加入足量的碘化鉀,再用氫氧化鈉溶液調至中性,并加入淀粉溶液。再用0.1000 mol·L1 Na2S2O3標準溶液滴定碘單質(I2+2S2O![]() =2I+S4O62—),達到滴定終點時用去15.00 mL Na2S2O3標準溶液,測得該水樣中ClO2的含量為________mg·L1。
=2I+S4O62—),達到滴定終點時用去15.00 mL Na2S2O3標準溶液,測得該水樣中ClO2的含量為________mg·L1。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com