
【題目】目前國際空間站處理CO2廢氣涉及的反應為CO2+4H2 ![]() CH4+2H2O.該反應的下列說法正確的是( )
CH4+2H2O.該反應的下列說法正確的是( )
A.釕催化劑能加快該反應的速率
B.升高溫度能加快該反應的速率
C.當達到一定限度時,CO2能100%轉化為CH4
D.當達到一定限度時,反應速率:v(正)=v(逆)=0,反應停止
【答案】AB
【解析】解:A.加入催化劑,可降低反應的活化能,增大反應速率,故A正確; B.升高溫度,活化分子數目增多,反應速率增大,故B正確;
C.為可逆反應,反應物不可能全部轉化,故C錯誤;
D.達到平衡時,正逆反應速率相等,但不為零,故D錯誤.
故選AB.
【考點精析】解答此題的關鍵在于理解化學平衡狀態本質及特征的相關知識,掌握化學平衡狀態的特征:“等”即 V正=V逆>0;“動”即是動態平衡,平衡時反應仍在進行;“定”即反應混合物中各組分百分含量不變;“變”即條件改變,平衡被打破,并在新的條件下建立新的化學平衡;與途徑無關,外界條件不變,可逆反應無論是從正反應開始,還是從逆反應開始,都可建立同一平衡狀態(等效).


科目:高中化學 來源: 題型:
【題目】下列各圖與表述一致的是( )

A. 圖①表示A、B兩物質的溶解度隨溫度變化情況,將t1℃時A、B飽和溶液分別升溫至t2℃時,溶質的質量分數B>A
B. 用圖②所示裝置蒸發FeCl3溶液制備無水FeCl3
C. 圖③可以表示向一定量的明礬溶液中逐滴摘加一定濃度氫氧化鋇溶液時產生Al(OH)3沉淀的物質的量變化
D. 圖④電解飽和食鹽水的裝置中,溶液A、B中由水電離出的c(H+):A>B
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】容積固定為3 L的某密閉容器中加入1 mol A、2 mol B,一定溫度下發生如下反應:A(s)+2B(g)![]() C(g)+D(g),經反應5 min后,測得C的濃度為0.3 mol·L-1。則下列說法中正確的是
C(g)+D(g),經反應5 min后,測得C的濃度為0.3 mol·L-1。則下列說法中正確的是
A. 5 min內D的平均反應速率為0.02 mol·L-1·min-1
B. 5 min內A的平均反應速率為0.06 mol·L-1·min-1
C. 經5 min后,向容器內再加入C,正反應速率變小
D. 平衡狀態時,生成1 mol D時同時生成1 mol A
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鹵族元素的單質和化合物很多,我們可以利用所學物質結構與性質的相關知識去認識和理解它們。
(1)鹵族元素位于元素周期表的_________區;溴的價電子排布式為_________;
(2)在一定濃度的溶液中,氫氟酸是以二分子締合(HF)2 形式存在的。使氫氟酸分子締合的作用力是________;
(3)已知碘酸(HIO3)和高碘酸(H5IO6)的結構分別如圖 I、 II 所示:
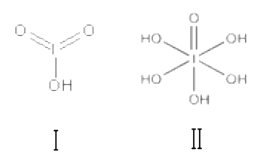
請比較二者酸性強弱: HIO3_____ (填“>”、“<”或“=”)H5IO6;
(4)已知 ClO2- 為 V 形結構,中心氯原子周圍有四對價層電子。ClO2-中心氯原子的雜化軌道類型為___________,寫出一個ClO2-的等電子體_________;
(5)如圖為碘晶體晶胞結構。有關說法中正確的是_____________。
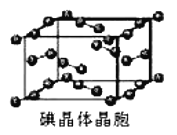
A.碘分子排列有2 種不同取向,2 種取向不同的碘分子以4 配位數交替配位形成層結構
B.用均攤法可知平均每個晶胞中有 4 個碘原子
C.碘晶體為無限延伸的空間結構,是原子晶體
D.碘晶體中存在的相互作用有非極性鍵和范德華力
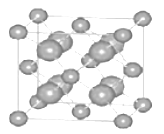
(6)已知 CaF2 晶體(如圖)的密度為 ρg/cm3, NA為阿伏加德羅常數,棱上相鄰的兩個 Ca2+的核間距為 a cm,則CaF2 的相對分子質量可以表示為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關物質的用途說法不正確的是
A. Si 可用于制造光導纖維 B. 鈉、鉀合金可用于原子反應堆作熱交換劑
C. FeCl3 溶液可作為銅質電路板蝕刻劑 D. 漂白粉可用于自來水殺菌消毒
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是
A. 丙烯分子所有原子均在同一平面上
B. 向溴水中分別通入乙烯加入苯,都能觀察到溴水褪色現象,但原因不同
C. C4H4只有![]() 和CH
和CH![]() C—CH=CH2兩種同分異構體
C—CH=CH2兩種同分異構體
D. 芳香烴![]() 和
和![]() 的一氯代物都只有2種
的一氯代物都只有2種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物的結構簡式為,下列有關該有機物的說法,正確的是( )

A. 該有機物的分子式為C14H9O9
B. 在酸性環境中,該有機物水解生成兩種有機物
C. 在NaOH溶液中,1 mol該有機物最多能和8 mol NaOH反應
D. 在催化劑存在的條件下,該有機物不能與H2發生加成反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com