
| 試 管 | 未加MnSO4的試管 | 加有MnSO4的試管 |
| 褪色時(shí)間 | 30s | 2s |
| 試 管 | 未滴加稀硫酸的試管 | 滴加了稀硫酸的試管 |
| 褪色時(shí)間 | 100s | 90s |
| 試 管 | 滴入10滴稀硫酸的試管 | 加入1mL稀硫酸的試管 | 加入2mL稀硫酸的試管 |
| 褪色時(shí)間 | 70s | 100s | 120s |
分析 (1)根據(jù)表中數(shù)據(jù)知,有硫酸錳的溶液褪色時(shí)間短,反應(yīng)速率快,沒(méi)有硫酸錳的溶液褪色時(shí)間長(zhǎng)、反應(yīng)速率慢;
(2)根據(jù)對(duì)比實(shí)驗(yàn)中不同物理量確定褪色時(shí)間長(zhǎng)短,從而確定反應(yīng)速率的影響因素;
(3)酸性條件下,高錳酸鉀具有強(qiáng)氧化性,能氧化還原性物質(zhì),所以草酸和高錳酸鉀發(fā)生氧化還原反應(yīng)生成硫酸錳、二氧化碳和水,導(dǎo)致溶液褪色;
滴定完成后仰視讀取KMnO4溶液體積會(huì)導(dǎo)致高錳酸鉀溶液體積偏大;
(4)根據(jù)流程圖知,酸性高錳酸鉀被還原生成二價(jià)錳離子,導(dǎo)致溶液褪色,且反應(yīng)開(kāi)始時(shí)高錳酸根離子被錳離子還原.
解答 解:(1)根據(jù)表中數(shù)據(jù)知,有硫酸錳的溶液褪色時(shí)間短,反應(yīng)速率快,沒(méi)有硫酸錳的溶液褪色時(shí)間長(zhǎng)、反應(yīng)速率慢,說(shuō)明硫酸錳作催化劑而加快反應(yīng)速率,故答案為:Mn2+(或硫酸錳)在反應(yīng)中起到催化劑的作用,加快了反應(yīng)速率[或需要Mn2+(硫酸錳)作催化劑];
(2)①根據(jù)實(shí)驗(yàn)II、III知,溫度不同其褪色時(shí)間不同,說(shuō)明溫度對(duì)該反應(yīng)速率有影響,故①正確;
②根據(jù)實(shí)驗(yàn)III知,混合溶液中硫酸濃度不同其褪色時(shí)間不同,說(shuō)明硫酸對(duì)草酸和KMnO4溶液的反應(yīng)有影響,故②正確;
③根據(jù)實(shí)驗(yàn)III知,加入少量硫酸,可促進(jìn)草酸和KMnO4溶液反應(yīng),褪色時(shí)間變短,而加入大量硫酸,反應(yīng)速率比較小,褪色時(shí)間加長(zhǎng),故③正確;
④根據(jù)實(shí)驗(yàn)三知,在酸性范圍內(nèi),pH值越小褪色時(shí)間越長(zhǎng),則對(duì)反應(yīng)越不利,故④錯(cuò)誤;
故答案為:①②③;
(3)酸性條件下,高錳酸鉀具有強(qiáng)氧化性,能氧化還原性物質(zhì),所以草酸和高錳酸鉀發(fā)生氧化還原反應(yīng)生成硫酸錳、二氧化碳和水,離子方程式為5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,導(dǎo)致溶液褪色,所以當(dāng)溶液由無(wú)色變?yōu)樽霞t色且半分鐘內(nèi)不變色時(shí),說(shuō)明達(dá)到滴定終點(diǎn);滴定完成后仰視讀取KMnO4溶液體積會(huì)導(dǎo)致高錳酸鉀溶液體積偏大,則導(dǎo)致測(cè)定溶液濃度偏大;
故答案為:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;從無(wú)色變?yōu)闇\紫紅色;偏大;
(4)根據(jù)流程圖知,酸性高錳酸鉀被還原生成二價(jià)錳離子,導(dǎo)致溶液褪色,且開(kāi)始時(shí)既有錳離子參加反應(yīng),只有實(shí)驗(yàn)I中加入硫酸錳,所以實(shí)驗(yàn)I可證明這個(gè)歷程是可信的,
故答案為:I.
點(diǎn)評(píng) 本題考查探究反應(yīng)速率的影響因素,側(cè)重考查學(xué)生實(shí)驗(yàn)操作、觀察、分析能力,知道物質(zhì)的性質(zhì)是設(shè)計(jì)實(shí)驗(yàn)的依據(jù),利用對(duì)比方法進(jìn)行實(shí)驗(yàn)并得出正確結(jié)論,題目難度中等.


 紅果子三級(jí)測(cè)試卷系列答案
紅果子三級(jí)測(cè)試卷系列答案 課堂練加測(cè)系列答案
課堂練加測(cè)系列答案
| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來(lái)源: 題型:解答題
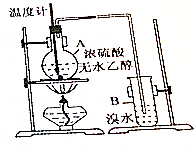 已知乙醇與濃硫酸加熱到170℃時(shí)可生成乙烯:
已知乙醇與濃硫酸加熱到170℃時(shí)可生成乙烯:查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:選擇題
| 坩堝的質(zhì)量 | 坩堝的質(zhì)量+晶體質(zhì)量 | 失水后坩堝的質(zhì)量+固體質(zhì)量 |
| 11.70g | 14.2g | 13.2g |
| A. | 晶體中含有不分解的雜質(zhì) | B. | 沒(méi)有放在干燥器中冷卻 | ||
| C. | 實(shí)驗(yàn)前,晶體表面吸附水 | D. | 沒(méi)有進(jìn)行恒重操作 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:選擇題
| A. | 氫氟酸的電離方程式及熱效應(yīng)可表示為:HF(aq)?H+(aq)+F-(aq)△H=+10.4kJ/mol | |
| B. | 當(dāng)V=20 mL時(shí),溶液中:c(OH-)=c(HF)+c(H+) | |
| C. | 當(dāng)V=20 mL時(shí),溶液中:c(F-)=c(Na+)=0.1mol/L | |
| D. | 當(dāng)v>0時(shí),溶液中一定存在c(Na+)>c(F-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:解答題
| 操作步驟 | 現(xiàn)象 |
| 步驟1:向20mL0.05mol•L-1AgNO3溶液中加入20mL0.05mol•L-1KSCN溶液,充分反應(yīng)后過(guò)濾 | 出現(xiàn)白色沉淀 |
| 步驟2:向?yàn)V液中滴加少量2mol•L-1Fe(NO3)3溶液 | 溶液變紅色 |
| 步驟3:向步驟2所得溶液中,加入少量3mol•L-1AgNO3溶液 | 現(xiàn)象a |
| 步驟4:取步驟1所得少量濾渣加入到適量的3mol•L-1KI溶液中 | 出現(xiàn)黃色沉淀 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:解答題
 請(qǐng)按要求回答下列問(wèn)題.
請(qǐng)按要求回答下列問(wèn)題.查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:解答題
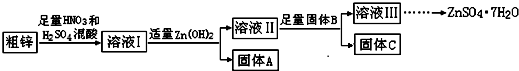
| 物質(zhì) | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS |
| Ksp | 4.0×10-38 | 5.0×10-20 | 2.0×10-16 | 8.5×10-45 | 1.2×10-23 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:選擇題
| A. | ①②④ | B. | ③④⑤ | C. | ②③⑤ | D. | ①⑤ |
查看答案和解析>>
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專(zhuān)區(qū) | 電信詐騙舉報(bào)專(zhuān)區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專(zhuān)區(qū) | 涉企侵權(quán)舉報(bào)專(zhuān)區(qū)
違法和不良信息舉報(bào)電話(huà):027-86699610 舉報(bào)郵箱:58377363@163.com