
分析 (1)海水中的Br-離子轉化為溴是利用氯氣的氧化性以后溴離子生成溴單質;
(2)熱空氣能吹出溴單質是利用了溴單質的揮發性,水中溶解性不大;
(3)同鹵素原子之間可形成鹵素互化物,其性質與鹵素單質相近,BrCln中溴元素化合價為+n價,氯元素化合價為-1價,結合氧化還原反應電子守恒、原子守配平得到化學方程式;
氫溴酸、鹽酸和硫酸混合溶液用堿將溶液調至中性后加入過量Ba(NO3)2,硫酸根轉化為硫酸鋇沉淀,充分反應后濾去沉淀物,再向濾液中加入過量的AgNO3溶液,最后得到鹵化銀沉淀12.37g為AgBr、AgCl,根據質量守恒可知,Ag元素的質量為12.37g-3.73g=8.64g,故其物質的量為0.08mol,根據Ag元素守恒計算參加反應的AgNO3的物質的量,由Ag守恒可知AgBr、AgCl總物質的量為0.08mol,結合二者總質量列方程計算各自物質的量,根據原子守恒計算BrClm中m的值.
解答 解:(1)海水中的Br-離子轉化為溴是利用氯氣的氧化性以后溴離子生成溴單質,在過程②中,海水中的Br-離子轉化為溴的離子方程式是2Br-+Cl2═2Cl-+Br2 ,
故答案為:2Br-+Cl2═2Cl-+Br2;
(2)過程③之所以能將溴以蒸氣狀態吹出,從物質結構知識角度來看是因為溴分子為非極性分子,不易溶于水,易揮發,
故答案為:溴分子為非極性分子,不易溶于水,易揮發;
(3)①同鹵素原子之間可形成鹵素互化物,其性質與鹵素單質相近,BrCln中溴元素化合價為+n價變化為-1價,電子轉移(n+1),氯元素化合價為-1價,硫元素化合價+4價變化為+6價,電子轉移2,結合氧化還原反應電子守恒、原子守配平得到化學方程式,2BrCln+(n+1)SO2+(2n+2)H2O=2HBr+2nHCl+(n+1)H2SO4,
故答案為:2、n+1、(2n+2)、H2O、2、2n、n+1;
②氫溴酸、鹽酸和硫酸混合溶液用堿將溶液調至中性后加入過量Ba(NO3)2,硫酸根轉化為硫酸鋇沉淀,充分反應后濾去沉淀物,再向濾液中加入過量的AgNO3溶液,最后得到鹵化銀沉淀12.37g為AgBr、AgCl,根據質量守恒可知,Ag元素的質量為12.37g-3.73g=8.64g,故其物質的量為$\frac{8.64g}{108g/mol}$=0.08mol,根據Ag元素守恒,參加反應n(AgNO3)=n(Ag元素)=0.08mol,
由Ag守恒可知AgBr、AgCl總物質的量為0.08mol,設AgBr、AgCl的物質的量分別為a mol、b mol,則:
a+b=0.08
188a+143.5b=12.37
解得a=0.02,b=0.06,
根據Br元素守恒,n(BrClm)=n(AgBr)=0.08mol,
根據Cl元素守恒,則0.02mol×m=0.06mol,故m=3,
故答案為:3.
點評 本題考查海水提取溴的過程分析判斷、氧化還原反應電子守恒、混合物計算,注意利用質量守恒定律確定鹵化銀中Ag元素質量,再利用元素守恒計算計算解答,題目難度中等,側重考查學生的分析計算能力.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | (1)(3)(6)(8)(9)(11) | B. | (2)(3)(6)(10)(11)(13) | C. | (3)(8)(9)(10)(11)(12) | D. | (4)(5)(7)(10)(11)(14) |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
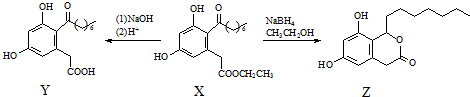
| A. | X、Y和Z中均不含手性碳原子 | |
| B. | Y能發生氧化、還原、取代反應 | |
| C. | 一定條件下,1 mol X最多能與5 mol H2發生加成反應 | |
| D. | 1 mol Z最多可與含3 mol NaOH的溶液反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com