
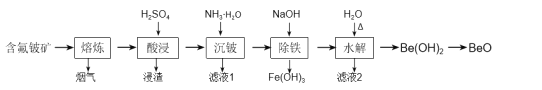
【題目】鈹是原子能、火箭、導彈、航空、宇宙航行以及冶金工業中不可缺少的一種新興材料。以某地的含氟鈹礦(主要成分為BeO、CaF2、Al2O3、Fe2O3、SiO2及少量的硫酸鹽)為原料,生產工業氧化鈹的一種工藝流程如圖:
已知:①25℃,Ksp(CaCO3)=8.7×10-9;Ksp(CaSO4)=2.5×10-5;
②Be(OH)2與Al(OH)3性質相似。
回答下列問題:
(1)“熔煉”的溫度為1600℃,其中約20%的Al2O3反應生成煙氣(主要成分為AlF3),該反應的化學方程式為___。
(2)浸渣的主要成分為CaSO4、___。
(3)加入氨水中和酸浸液,若將pH調至8~9,“沉鈹”時產生的沉淀物主要有:___、___、___。
(4)“沉鈹”后將濾渣加入足量氫氧化鈉溶液提高pH進行“除鐵”,鈹元素參與反應的離子方程式為___,然后加適量水稀釋進行“水解”,目的是___。
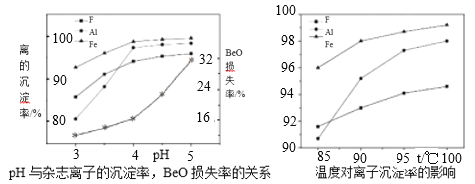
(5)若為高氟鈹礦,需在“沉鈹”前進行“除氟”。工業上“除氟”是加入10%的氨水,并控制一定的條件,使氟與鋁鐵形成共沉淀物而除去。根據如圖實驗數據,選擇的實驗條件為pH=___,水浴加熱溫度T=___℃。
(6)氧化鈹粗產品含有一定量的硫酸鹽會影響鈹的后續冶煉,可用碳酸鹽脫除,發生反應:CaSO4(s)+Na2CO3(aq)=CaCO3(s)+Na2SO4(aq)。通過計算反應的K值說明用碳酸鈉脫硫酸根反應的程度大小:__。
【答案】Al2O3+3CaF2![]() 2AlF3↑+3CaO SiO2 Fe(OH)3 Be(OH)2 Al(OH)3 Be(OH)2+2OH-=BeO22-+H2O或Be(OH)2+2OH-=Be(OH)42- 稀釋使溶液的堿性變弱,BeO22-水解,分離除去沉淀中的鋁元素 4 95 K=
2AlF3↑+3CaO SiO2 Fe(OH)3 Be(OH)2 Al(OH)3 Be(OH)2+2OH-=BeO22-+H2O或Be(OH)2+2OH-=Be(OH)42- 稀釋使溶液的堿性變弱,BeO22-水解,分離除去沉淀中的鋁元素 4 95 K=![]() =
= =2.9×103,K值很大,說明轉化反應程度很大
=2.9×103,K值很大,說明轉化反應程度很大
【解析】
含氟鈹礦(主要成分為BeO、CaF2、Al2O3、Fe2O3、SiO2及少量的硫酸鹽)經過熔煉,發生反應Al2O3+3CaF2![]() 2AlF3↑+3CaO,“熔煉”后的主要成分BeO、CaF2、Al2O3、Fe2O3、SiO2、CaO與硫酸反應,因SiO2與硫酸不反應,而CaSO4微溶于水,則“酸浸”除去二氧化硅等,“酸浸”后濾液中的離子主要為H+、Fe3+、Be2+、Al3+、SO42-等,“沉鈹”后Fe3+、Be2+、Al3+轉化為沉淀Fe(OH)3、Be(OH)2、Al(OH)3,加入氫氧化鈉后Be(OH)2、Al(OH)3溶解生成BeO22-、AlO2-并除去氫氧化鐵,最后加適量的水稀釋使溶液的堿性變弱,讓BeO22-水解轉化為Be(OH)2水解得到氫氧化鈹。
2AlF3↑+3CaO,“熔煉”后的主要成分BeO、CaF2、Al2O3、Fe2O3、SiO2、CaO與硫酸反應,因SiO2與硫酸不反應,而CaSO4微溶于水,則“酸浸”除去二氧化硅等,“酸浸”后濾液中的離子主要為H+、Fe3+、Be2+、Al3+、SO42-等,“沉鈹”后Fe3+、Be2+、Al3+轉化為沉淀Fe(OH)3、Be(OH)2、Al(OH)3,加入氫氧化鈉后Be(OH)2、Al(OH)3溶解生成BeO22-、AlO2-并除去氫氧化鐵,最后加適量的水稀釋使溶液的堿性變弱,讓BeO22-水解轉化為Be(OH)2水解得到氫氧化鈹。
(1)根據元素守恒分析,Al2O3轉化為煙氣AlF3,應為Al2O3與CaF2發生復分解反應:Al2O3+3CaF2![]() 2AlF3↑+3CaO。
2AlF3↑+3CaO。
(2)“熔煉”后適當冷卻加入硫酸進行“酸浸”,主要是含氟鈹礦中各種氧化物BeO、CaF2、Al2O3、Fe2O3、SiO2、CaO與硫酸反應,因SiO2與硫酸不反應,而CaSO4微溶于水,故浸渣的主要成分為CaSO4、SiO2。
(3)酸浸后濾液中的離子主要為H+、Fe3+、Be2+、Al3+、SO42-等,加入氨水中和酸浸液,pH調至8~9時,Fe3+、Be2+、Al3+轉化為沉淀Fe(OH)3、Be(OH)2、Al(OH)3。
(4)“沉鈹”后將濾渣加入足量氫氧化鈉溶液提高pH進行“除鐵”,因Fe(OH)3不與氫氧化鈉反應,Be(OH)2、Al(OH)3性質相似為兩性氫氧化物能與氫氧化鈉溶液反應,發生Be(OH)2+2OH-=BeO22-+H2O、Al(OH)3+OH-=AlO2-+2 H2O,將Fe(OH)3分離,溶液中陰離子主要是BeO22-、AlO2-,后加適量水稀釋進行“水解”,根據流程中的得到的信息“水解”目的是得到Be(OH)2,故說明流程中加適量的水是稀釋使溶液的堿性變弱,讓BeO22-水解轉化為Be(OH)2,分離除去沉淀中的鋁元素。
(5)若為高氟鈹礦則“酸浸”后溶液中含有大量的氟離子,氟離子濃度偏大會與Be2+形成配合物溶于水而增加了鈹的損失率,因此需在“沉鈹”前進行“除氟。根據題目信息工業上“除氟”是加入10%的氨水,并控制一定的條件,使氟與鋁鐵形成共沉淀物而除去。圖1明顯在pH=4時F、Al、Fe的沉淀率高,但pH高于4時,鈹的損失率增大,故實驗條件為pH=4,由圖2看出溫度在95℃后雜質離子的除去率高,故水浴加熱溫度為95℃。
(6)反應:CaSO4(s)+Na2CO3(aq)=CaCO3(s)+Na2SO4(aq)的K=![]() =
= =2.9×103,因為K值很大,說明CaSO4(s)+Na2CO3(aq)=CaCO3(s)+Na2SO4(aq)反應程度很大。
=2.9×103,因為K值很大,說明CaSO4(s)+Na2CO3(aq)=CaCO3(s)+Na2SO4(aq)反應程度很大。


科目:高中化學 來源: 題型:
【題目】某小組在實驗室探究Ba(OH)2溶液與稀鹽酸反應的實質。向0.2mol/L Ba(OH)2溶液中滴加0.1mol/L鹽酸,測定導電率的變化如圖所示,回答下列問題:

(1)Ba(OH)2在水中以離子形式存在的實驗證據是___________。Ba(OH)2的電離方程式為___________。
(2)A-B段,發生的離子反應是__________。
(3)B點恰好完全反應,此時溶液中存在的微粒有H2O、__________。
(4)下列化學反應的實質與Ba(OH)2溶液與稀鹽酸反應的實質相同的是__________。
A. Ba(OH)2和H2SO4 B. NaOH和H2SO4 C. Ba(OH)2與HNO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉛酸蓄電池價格低廉,原材料易得,適用范圍廣。其放電時的反應原理為:
Pb+PbO2+2H2SO4===2PbSO4+2H2O。

(1) 寫出鉛酸蓄電池放電時正極的電極反應式:________,放電時,H+向電池______極定向移動(填“正”或“負”)。
(2) 傳統的鉛酸蓄電池在充電末期,電極上會產生O2,為了避免氣體逸出形成酸霧腐蝕設備,科學家發明了密封鉛蓄電池(VRLA),采用陰極吸收法達到密封效果。其原理如圖所示,則O2在陰極被吸收的電極反應式為________。
(3) 鉛的電解精煉是工業上實現廢鉛回收以及粗鉛提純的重要手段。鉛的電解精煉在由PbSiF6和H2SiF6兩種強電解質組成的水溶液中進行。從還原爐中產出的某粗鉛成分如下表所示:
成分 | Pb | Cu | Ag | Fe | Zn | Sn | 其它 |
% | 97.50 | 1.22 | 0.12 | 0.15 | 0.09 | 0.64 | 0.28 |
①電解精煉時陽極泥的主要成分是________(元素符號)。
②電解后陰極得到的鉛中仍含有微量的雜質,該雜質最有可能是________(填一種)。
③電解過程中,粗鉛表面會生成SiF6氣體,寫出該電極反應式________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA 表示阿伏加德羅常數,下列敘述正確的是( )
A.常溫常壓下,4gH2含有的分子數為2NA
B.17g氨氣所含電子數目為8NA
C.將1體積c1mol/L的硫酸溶于4體積水中 ,稀溶液的濃度為0.2c1mol/L
D.將5.85gNaCl 晶體溶入100mL水中,制得0.1mol/L的NaCl溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞硝酰氯( NOCl) 是有機合成中的重要試劑,為黃色氣體或紅褐色液體(熔點- 64. 5℃,沸點-5.5℃),具有刺鼻惡臭味,遇水和潮氣水解,有多種方法制備。
(1)方法一:將5 g 經300℃下干燥了 3h 并研細的 KCl 粉末裝入 50 mL 帶有接頭及抽真空用活塞的玻璃容器內。將容器盡量減壓,在減壓下通入0. 002 mol NO2。反應 12 ~ 36 min 即可完成,NO2紅棕色消失 ,出現黃色亞硝酰氯,同時還得到一種鹽。寫出亞硝酰氯的電子式________,該方法制備NOCl的化學方程式為_________________,氯化鉀需要“干燥”的原因是_______________。
(2)方法二:實驗室可用如圖裝置制備亞硝酰氯(NOCl),檢驗裝置氣密性并裝入藥品打開 K2,然后再打開___________(填“K1 ”或"“K3 ”) 通入一段時間氣體,其目的為______,然后進行其他操作,當 Z 有一定量液體生成時,停止實驗。寫出X 裝置中反應的離子方程式_____________________ 。

(3)測定產品純度:取(2)中w g Z 中液態產品溶于蒸餾水,配制成250 ml 溶液;用酸式滴定管準確量取25. 00mL 所配溶液于錐形瓶中,滴加幾滴 K2CrO4溶液作指示劑,用滴定管盛裝 c mol·L-1 AgNO3標準溶液滴定至終點,消耗標準溶液體積為V mL。[已知:Ksp( AgCl ) =1.56 ×10-10 ,Ksp(Ag2CrO4)=1×10-12,Ag2CrO4為磚紅色固體,忽略雜質參與反應]
①盛裝AgNO3 標準溶液的滴定管是____(填“酸式”或“堿式”)棕色滴定管;判斷達到滴定終點的方法是_____________________。
②該產品純度為_____________(用代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】太和一中理化創新社的同學們為了探究在實驗室制備![]() 的過程中有水蒸氣和
的過程中有水蒸氣和![]() 揮發出來,同時證明氯氣的某些性質,甲同學設計了如圖所示的實驗裝置(支撐用的鐵架臺省略),按要求回答問題。
揮發出來,同時證明氯氣的某些性質,甲同學設計了如圖所示的實驗裝置(支撐用的鐵架臺省略),按要求回答問題。

(1)若用含有![]() 的濃鹽酸與足量的
的濃鹽酸與足量的![]() 反應制
反應制![]() ,制得的
,制得的![]() 體積(標準狀況下)總是小于
體積(標準狀況下)總是小于![]() 的原因是_____________________。
的原因是_____________________。
(2)①裝置B的作用是_______________________,現象是_____________________。
②裝置C和D出現的不同現象說明的問題是__________________________。
③裝置E的作用是_______________________________。
(3)乙同學認為甲同學的實驗有缺陷,不能確保最終通入![]() 溶液中的氣體只有一種。為了確保實驗結論的可靠性,證明最終通入
溶液中的氣體只有一種。為了確保實驗結論的可靠性,證明最終通入![]() 溶液的氣體只有一種,乙同學提出在某兩個裝置之間再加一個裝置。你認為該裝置應加在_________與_________之間(填裝置字母序號),裝置中應放入___________________________。
溶液的氣體只有一種,乙同學提出在某兩個裝置之間再加一個裝置。你認為該裝置應加在_________與_________之間(填裝置字母序號),裝置中應放入___________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究團隊在優化催化劑的基礎上,通過調節電極的孔道和疏水性增加CO的擴散速率,實現了高選擇性將CO電解還原制備乙烯,如圖所示。下列敘述錯誤的是( )
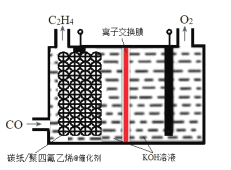
A.碳紙/聚四氟乙烯電極為陰極
B.聚四氟乙烯的作用是吸附并增加CO的濃度
C.為了維持電解的效率,離子交換膜應為陽離子交換膜
D.碳紙上生成C2H4的電極反應式為:2CO+6H2O+8e-=C2H4+8OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的值。下列敘述中正確的是( )
A. 分子總數為NA的二氧化硫和二氧化碳混合氣體中含有的原子數為3NA
B. 任何條件下,20 L 氧氣含有的分子數都不可能為NA
C. 在標準狀況下,2 g氖氣含有NA個氖原子
D. 物質的量相等的任何氣體中都含有相同的原子數
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關Na2CO3和NaHCO3的敘述中,正確的是( )
A.NaHCO3俗名純堿,Na2CO3俗名蘇打
B.受熱時,NaHCO3比Na2CO3容易分解
C.NaHCO3溶液顯酸性,Na2CO3溶液顯堿性
D.NaHCO3和Na2CO3各1mol分別與過量鹽酸充分反應,產生CO2的質量不同
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com