
 最常見的塑化劑鄰苯二甲酸二丁酯可由鄰苯二甲酸酐與正丁醇在濃硫酸共熱下反應制得,反應的化學方程式及裝置圖(部分裝置省略)如圖:
最常見的塑化劑鄰苯二甲酸二丁酯可由鄰苯二甲酸酐與正丁醇在濃硫酸共熱下反應制得,反應的化學方程式及裝置圖(部分裝置省略)如圖: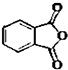 +C4H9OH$\stackrel{H_{2}SO_{4}}{→}$
+C4H9OH$\stackrel{H_{2}SO_{4}}{→}$ 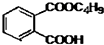 $→_{C_{4}H_{9}OH}^{H_{2}SO_{4}}$
$→_{C_{4}H_{9}OH}^{H_{2}SO_{4}}$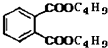
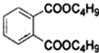 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +2CH3CH2CH2CH2OH.
+2CH3CH2CH2CH2OH.分析 (1)水是生成物,不斷的分離生成物,使平衡向著正向移動,可以提高反應物的轉化率;反應結束時,分水器中的水位高度不變,冷凝管中不再有液體滴下;
(2)正丁醇可能發生消去反應,也可以發生分子間脫水反應生成醚等;
(3)若使用氫氧化鈉溶液,會發生鄰苯二甲酸二丁酯在堿性條件下的水解反應生成 與正丁醇;
與正丁醇;
(4)操作X是將互不相溶的液體進行分離,應采取分液操作;
(5)鄰苯二甲酸二丁酯的沸點340℃,溫度超過180℃時易發生分解,應減壓蒸餾使其沸點降低,防止分解;
(6)由于正丁醇不足,假設鄰正丁醇完全轉化,以此計算鄰苯二甲酸二丁酯的理論產量,產率=(實際產量÷理論產量)×100%.
解答 解:(1)水是生成物,不斷的分離生成物,使平衡向著正向移動,可以提高反應物的轉化率;分水器中的水位高度基本保持不變時(或者冷凝管中不再有液體滴下),說明反應結束,
故答案為:有利于反應向生成鄰苯二甲酸二丁酯的方向移動,提高產率;分水器中的水位高度基本保持不變時(或者冷凝管中不再有液體滴下);
(2)正丁醇可能發生消去反應,也可以發生分子間脫水反應生成醚等,實驗中副產物的結構簡式為:CH2=CHCH2CH3 、CH3CH2CH2CH2OCH2CH2CH2CH3等,
故答案為:CH2=CHCH2CH3、CH3CH2CH2CH2OCH2CH2CH2CH3等;
(3)若使用氫氧化鈉溶液,會發生鄰苯二甲酸二丁酯在堿性條件下的水解反應生成 與正丁醇,反應方程式為:
與正丁醇,反應方程式為: +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +2CH3CH2CH2CH2OH,
+2CH3CH2CH2CH2OH,
故答案為: +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +2CH3CH2CH2CH2OH;
+2CH3CH2CH2CH2OH;
(4)操作X是將互不相溶的液體進行分離,應采取分液操作,操作中必須使用的主要玻璃儀器有:分液漏斗、燒杯,
故答案為:分液漏斗、燒杯;
(5)鄰苯二甲酸二丁酯沸點較高,高溫蒸餾會造成其分解,減壓可使其沸點降低,防止分解,
故答案為:鄰苯二甲酸二丁酯沸點較高,高溫蒸餾會造成其分解,減壓可使其沸點降低;
(6)由于正丁醇不足,假設正丁醇完全轉化,則鄰苯二甲酸二丁酯的理論產量為$\frac{0.3mol}{2}$×278g/mol=41.7g,故其產率為$\frac{20.85g}{41.7g}$×100%=50%,
故答案為:50%.
點評 本題有機物的制備實驗,涉及物質的分離提純、對操作及原理的分析評價、產率計算等,掌握實驗操作的要求和實驗原理是解題的關鍵,難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | H2>O2>CO>CO2 | B. | H2>CO>O2>CO2 | C. | CO2>O2>CO>H2 | D. | CO2>H2>O2>CO |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


| 滴定次數 | 1 | 2 | 3 |
| 消耗Na2S2O3溶液(mL) | 19.98 | 21.18 | 20.02 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
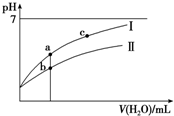 已知:25°C時某些弱酸的電離平衡常數(如表).下面圖象表示常溫下,稀釋CH3COOH、HClO兩種酸的稀溶液時,溶液pH隨加水量的變化.下列說法正確的是( )
已知:25°C時某些弱酸的電離平衡常數(如表).下面圖象表示常溫下,稀釋CH3COOH、HClO兩種酸的稀溶液時,溶液pH隨加水量的變化.下列說法正確的是( )| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同濃度CH3COONa和NaClO的混合液中,各離子濃度的大小關系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通入少量二氧化碳的離子方程式為:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | 圖象中a、c兩點處的溶液中$\frac{c({R}^{-})}{c(O{H}^{-})•c(HR)}$相等(HR代表CH3COOH或HClO) | |
| D. | 圖象中a點酸的總濃度大于b點酸的總濃度 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
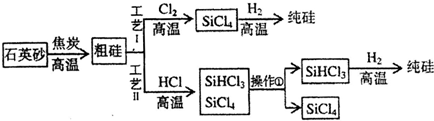
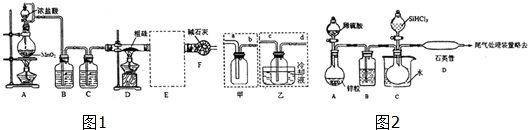
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ${\;}_{8}^{18}$O2-離子結構示意圖: | B. | NH4Cl的電子式: | ||
| C. | 含78個中子的碘的核素:53131I | D. | 二氧化硅的分子式:SiO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 苯酚和苯都能和溴水發生苯環上的取代反應 | |
| B. | 醇屬于烴的衍生物,飽和一元醇的組成符合CnH2nO | |
| C. | 乙醇是無色透明的液體,密度比水小,能用乙醇從碘水中萃取出碘 | |
| D. | 向苯酚鈉溶液中通入CO2氣體,使溶液變渾濁,說明碳酸的酸性比苯酚的強 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.5 mol/(L•min) | B. | 1 mol/(L•min) | C. | 2 mol/(L•min) | D. | 3 mol/(L•min) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com