
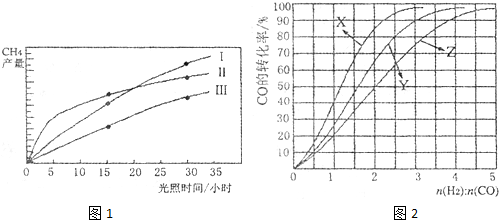
(14分)利用光能和光催化劑,可將CO2和H2O(g)轉化為CH4和O2。紫外光照射時,在不同催化劑(I,II,III)作用下,CH4產量隨光照時間的變化如圖所示。

(1)在0-30小時內,CH4的平均生成速率vⅠ、vⅡ和vⅢ從大到小的順序為 ;
反應開始后的12小時內,在第 種催化劑的作用下,收集的CH4最多。
(2)將所得CH4與H2O(g)通入聚焦太陽能反應器,發生反應:CH4(g)+H2O(g) CO(g)+3H2(g),該反應的ΔH=+206 kJ•mol-1將等物質的量的CH4和H2O(g)充入1L恒容密閉容器,某溫度下反應達到平衡,平衡常數K=27,此時測得CO的物質的量為0.10mol,求CH4的平衡轉化率(計算結果保留兩位有效數字)
CO(g)+3H2(g),該反應的ΔH=+206 kJ•mol-1將等物質的量的CH4和H2O(g)充入1L恒容密閉容器,某溫度下反應達到平衡,平衡常數K=27,此時測得CO的物質的量為0.10mol,求CH4的平衡轉化率(計算結果保留兩位有效數字)
(3)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802kJ•mol-1
寫出由CO2生成CO的熱化學方程式
(1)VⅢ>VⅡ> VⅠ;Ⅱ。 (2)三步計算可求CH4的轉化率為:0.1/0.11=0.91
(3)CO2(g) +3H2O(g) =2O2(g) +CO(g)+3H2(g) △H=+1008 kJ•mol-1
【解析】
試題分析:(1)由圖像可以看出,反應進行到30小時時,催化劑Ⅲ生成的甲烷最多,其次是催化劑Ⅱ,催化劑Ⅰ生成的甲烷最少。因此VI、VII和VIII從大到小的順序為VIII>VII>VI>;同理由圖像也可以看出,反應進行到12小時時,催化劑Ⅱ生成的甲烷最多,因此在第Ⅱ種催化劑的作用下,收集的CH4最多。
(2)設CH4、H2O的物質的量均為xmol,則
CH4(g)
+ H2O(g)  CO(g)
+ 3H2(g)
CO(g)
+ 3H2(g)
起始量(mol) x x 0 0
變化量(mol) 0.10 0.10 0.10 0.30
平衡量(mol) x- 0.10 x- 0.10 0.10 0.30
根據題意,則平衡常數K=c(CO)·c3(H2)/[c(CH4)·c(H2O)]=(0.10mol·L-1)·(0.30mol·L-1)3/[(x-0.10)mol·L-1·(x- 0.10)mol·L-1]=27(mol·L-1)2,則x=0.11mol,所以CH4的轉化率為0.1/0.11=0.91。
(3)由熱化學方程式①CH4(g)+H2O(g) CO(g)+3H2(g)
ΔH=+206 kJ•mol-1②CH4(g)+2O2(g)=CO2(g)+2H2O(g)
ΔH=-802kJ•mol-1,①-②得CO2(g)
+3H2O(g)
=2O2(g) +CO(g)+3H2(g)
△H=+1008 kJ•mol-1。
CO(g)+3H2(g)
ΔH=+206 kJ•mol-1②CH4(g)+2O2(g)=CO2(g)+2H2O(g)
ΔH=-802kJ•mol-1,①-②得CO2(g)
+3H2O(g)
=2O2(g) +CO(g)+3H2(g)
△H=+1008 kJ•mol-1。
考點:本題考查化學反應速率的概念、計算及外界條件對反應速率對影響;反應熱的概念和蓋斯定律的計算;與化學平衡有關的計算。
點評:本題綜合性強,是高考中的熱點考題,主要考查學生的分析問題,解決問題的能力。


科目:高中化學 來源: 題型:閱讀理解
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
 (2011?廣東)利用光能和光催化劑,可將CO2和H2O(g)轉化為CH4和O2.紫外光照射時,在不同催化劑(I,II,III)作用下,CH4產量隨光照時間的變化如圖所示.
(2011?廣東)利用光能和光催化劑,可將CO2和H2O(g)轉化為CH4和O2.紫外光照射時,在不同催化劑(I,II,III)作用下,CH4產量隨光照時間的變化如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
利用光能和光催化劑,可將CO2和H2O(g)轉化為CH4和O2。紫外光照射時,在不同催化劑(I,II,III)作用下,CH4產量隨光照時間的變化如圖13所示。

(1)在0-30小時內,CH4的平均生成速率VⅠ、VⅡ和VⅢ從大到小的順序為 ;
反應開始后的12小時內,在第 種催化劑的作用下,收集的CH4最多。
(2)將所得CH4與H2O(g)通入聚焦太陽能反應器,發生反應:CH4(g)+H2O(g)![]() CO(g)+3H2(g),該反應的△H=+206 kJ•mol-1
CO(g)+3H2(g),該反應的△H=+206 kJ•mol-1
將等物質的量的CH4和H2O(g)充入1L恒容密閉容器,某溫度下反應達到平衡,平衡常數K=27,此時測得CO的物質的量為0.10mol,求CH4的平衡轉化率(計算結果保留兩位有效數字)
(3)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g) △H=-802kJ•mol-1
寫出由CO2生成CO的熱化學方程式
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com