
| 實驗序號 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的體積/mL | 20.05 | 20.00 | 18.80 | 19.95 |
| 醋酸濃度(mol•L-1 ) | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
分析 (1)根據儀器的用途選取儀器;
(2)根據NaOH的體積,第3次數據顯然誤差較大,舍去;另外三次所用NaOH平均體積為20 mL,代入計算;
(3)根據部分電離的電解質是弱電解質判斷;
(4)醋酸濃度越小,醋酸的電離程度越大;
(5)探究溫度對醋酸的電離程度的影響,應控制其他條件相同,只有溫度存在差異的醋酸溶液H+濃度有差異,能夠對溶液中H+濃度區分度較好的儀器是pH計.
解答 解:(1):(1)根據儀器的用途選取儀器,用膠頭滴管定容,用250mL容量瓶配制溶液,
故答案為:膠頭滴管;250 mL容量瓶;
(2)根據NaOH的體積,第3次數據顯然誤差較大,舍去;另外三次所用NaOH平均體積為20.00mL,
則醋酸溶液濃度=$\frac{0.2000mol/L×0.02L}{0.02L}$=0.2000 mol/L,
故答案為:0.2000 mol/L;
(3)孤立的看每次測量值,H+濃度遠小于醋酸的濃度,說明醋酸不完全電離;聯系起來看,濃度為0.100 0 mol•L-1、0.010 0 mol•L-1及0.001 0 mol•L-1的醋酸,pH變化值小于1,所以醋酸是弱電解質,
故答案為:0.010 0 mol•L-1醋酸的pH大于2或醋酸稀釋10倍時,pH的變化值小于1;
(4)以0.100 0 mol•L-1、0.010 0 mol•L-1醋酸為例,設0.100 0 mol•L-1的醋酸溶液體積為1 L,將其稀釋至0.010 0 mol/L,體積變為10 L,兩溶液中H+的物質的量分別為:10-2.88 mol、10-2.38 mol,可見溶液變稀,電離出的H+的物質的量增大,故說明醋酸的電離程度增大,可以可得出的另一個結論為:隨著醋酸濃度的減小,醋酸的電離程度增大,
故答案為:增大;
(5)探究溫度對醋酸的電離程度的影響,應控制其他條件相同,只有溫度存在差異的醋酸溶液H+濃度有差異,能夠對溶液中H+濃度區分度較好的儀器是pH計,
故答案為:用pH計(或精密pH試紙)測定相同濃度的醋酸在幾種不同溫度時的pH.
點評 本題考查了弱電解質電離及實驗探究,明確弱電解質電離特點是解本題關鍵,難點是實驗設計,設計實驗時要注意只改變一個條件,為易錯點,試題培養了學生的分析能力及化學實驗能力.


 黃岡冠軍課課練系列答案
黃岡冠軍課課練系列答案科目:高中化學 來源: 題型:選擇題
| A. | CO2 | B. | N2 | C. | SO2 | D. | CO |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 不能用手直接接觸藥品 | B. | 可用酒精燈對燒杯直接加熱 | ||
| C. | 用鼻孔湊到容器口去聞氣體的氣味 | D. | 嘗一下實驗室里酒精的味道 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 質子數為53、中子數為78的碘原子:${\;}_{53}^{131}$I | |
| B. | N2的電子式: | |
| C. | S2-的結構示意圖: | |
| D. | 丙醛的結構簡式:CH3CH2COH |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2O2、Na2O2都屬于過氧化物,都存在共價鍵 | |
| B. | 雙氧水是綠色氧化劑,可作醫療消毒劑 | |
| C. | H2O2既有氧化性,又有還原性,與Cl2、KMnO4反應是表現H2O2的氧化性 | |
| D. | H2O2做漂白劑是利用其氧化性,漂白原理與HClO類似,與SO2不同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | AgNO3 和Cu(NO3)2 | B. | Cu(NO3)2和Fe(NO3)2 | C. | AgNO3 和Fe(NO3)2 | D. | Fe(NO3)2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
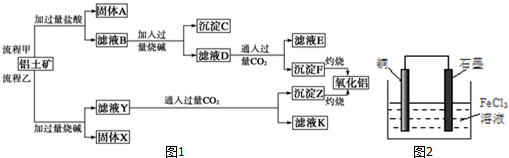
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
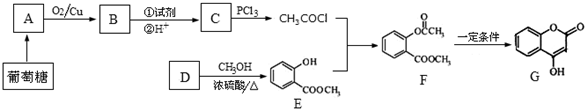
 +NaOH→
+NaOH→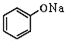 +H2O
+H2O .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,4g H2含有的分子數為 2NA | |
| B. | 8g H2O在標準狀況下的體積是22.4L | |
| C. | 2.4g金屬鎂變為鎂離子時失去的電子數為NA | |
| D. | 17g氨氣所含電子數目為8NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com