
【題目】金屬鐵用途廣泛,高爐煉鐵的總反應為:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g),請回答下列問題:
2Fe(s)+3CO2(g),請回答下列問題:
(1)一定溫度下,在體積固定的密閉容器中發(fā)生上述反應,可以判斷該反應已經達到平衡的是___________
A.密閉容器中總壓強不變
B.密閉容器中混合氣體的平均摩爾質量不變
C.密閉容器中混合氣體的密度不變
D.c(CO)=c(CO2)
E.Fe2O3的質量不再變化
(2)一定溫度下,上述反應的化學平衡常數為3.0,該溫度下將4molCO、2molFe2O3、6molCO2、5molFe加入容積為2L的密閉容器中,此時反應將向________________反應方向進行(填“正”或“逆”或“處于平衡狀態(tài)”);反應達平衡后,若升高溫度,CO與CO2的體積比增大,則正反應為______________反應(填“吸熱”或“放熱”)。
(3)已知:3Fe2O3(s)+CO(g)![]() 2Fe3O4(s)+CO2(g) △H=–47kJ/mol
2Fe3O4(s)+CO2(g) △H=–47kJ/mol
Fe3O4(s)+CO(g)![]() 3FeO(s)+CO2(g) △H=+19kJ/mol
3FeO(s)+CO2(g) △H=+19kJ/mol
FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H=–11kJ/mol
Fe(s)+CO2(g) △H=–11kJ/mol
則Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)的 △H=________________。
2Fe(s)+3CO2(g)的 △H=________________。
【答案】BCE 逆 放熱 -25kJ/mol
【解析】
(1)A.利用相同條件下,壓強之比等于氣體物質的量之比進行分析;
B.利用摩爾質量的定義進行分析;
C.利用密度的定義進行分析;、
D.利用平衡狀態(tài)的定義進行分析和判斷;
E.根據化學平衡狀態(tài)的定義進行分析和判斷;
(2)利用Q和K的關系進行分析和判斷;
(3)利用蓋斯定律進行分析和計算;
(1)A. 相同條件下,氣體壓強之比等于氣體物質的量之比,Fe2O3、Fe為固體,CO和CO2為氣體,且反應前后氣體系數之和相等,因此反應任何時刻,壓強都是相等,因此密閉容器中總壓強不變,不能說明反應達到平衡,故A不符合題意;
B. 根據M=![]() ,反應前后氣體系數之和相等,即氣體物質的量始終不變,根據反應方程式,向正反應方向進行,氣體質量增大,因此當氣體平均摩爾質量不變,說明該反應達到平衡,故B符合題意;
,反應前后氣體系數之和相等,即氣體物質的量始終不變,根據反應方程式,向正反應方向進行,氣體質量增大,因此當氣體平均摩爾質量不變,說明該反應達到平衡,故B符合題意;
C. 根據密度的定義,容器為體積不變,即氣體體積保持不變,根據B選項分析,氣體質量發(fā)生變化,即當氣體密度保持不變,說明該反應達到平衡,故C符合題意;
D. 根據化學平衡狀態(tài)的定義,平衡時各組分的濃度保持不變,但c(CO)=c(CO2),不能作為達到平衡的標志,故D不符合題意;
E. Fe2O3為反應物,隨著反應進行,氧化鐵的質量逐漸減小,當氧化鐵的質量不再變化,說明該反應達到平衡,故E符合題意;
(2)Fe2O3、Fe為固體,因此該反應化學平衡常數的表達式為K=![]() ,該溫度下將4molCO、2molFe2O3、6molCO2、5molFe加入容積為2L的密閉容器中,判斷反應進行的方向,需要根據Q和K之間的關系進行判斷,Q=
,該溫度下將4molCO、2molFe2O3、6molCO2、5molFe加入容積為2L的密閉容器中,判斷反應進行的方向,需要根據Q和K之間的關系進行判斷,Q=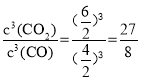 >K=3,該反應向逆反應方向進行;升高溫度,CO與CO2的體積比增大,說明平衡向逆反應方向移動,根據勒夏特列原理,正反應為放熱反應;
>K=3,該反應向逆反應方向進行;升高溫度,CO與CO2的體積比增大,說明平衡向逆反應方向移動,根據勒夏特列原理,正反應為放熱反應;
(3) 3Fe2O3(s)+CO(g)![]() 2Fe3O4(s)+CO2(g) △H=–47kJ/mol ①
2Fe3O4(s)+CO2(g) △H=–47kJ/mol ①
Fe3O4(s)+CO(g)![]() 3FeO(s)+CO2(g) △H=+19kJ/mol ②
3FeO(s)+CO2(g) △H=+19kJ/mol ②
FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H=–11kJ/mol ③
Fe(s)+CO2(g) △H=–11kJ/mol ③
根據目標反應方程式以及蓋斯定律可知,![]() ,△H=-25kJ/mol。
,△H=-25kJ/mol。


科目:高中化學 來源: 題型:
【題目】“清肺排毒湯”對新冠肺炎病毒感染具有良好的效果,其中一味中藥黃芩的一種活性中間體的結構為: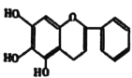 ,現在可人工合成,路線如圖所示:
,現在可人工合成,路線如圖所示:
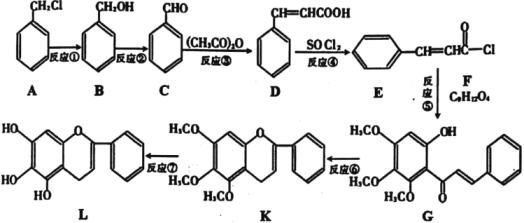
(1)A生成B的反應條件是___,B生成C的反應條件為___。
(2)合成過程中,屬于取代反應的是___。
(3)F的結構簡式為___。
(4)D在一定條件下能生成高分子化合物,請寫出該反應的化學方程式___。同時符合下列三個條件的D的同分異構體共有___種。
a.能發(fā)生銀鏡反應;
b.苯環(huán)上有3個取代基;
c.與FeCl3溶液發(fā)生顯色反應。
(5)依據以上合成信息,以乙烯和氯苯為原料合成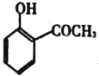 路線,無機試劑自選___。
路線,無機試劑自選___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】減少氮的氧化物和碳的氧化物在大氣中的排放是環(huán)境保護的重要內容之一。合理應用和處理碳、氮及其化合物,在生產生活中有重要意義。
(1)對溫室氣體 CO2 的研究一直是科技界關注的重點。在催化劑存在下用 H2 還原 CO2 是解決溫室效應的重要手段之一。
已知:①H2 和 CH4 的燃燒熱分別為 285.5 kJ/mol 和 890.0 kJ/mol。
②H2O(1)===H2O(g) ΔH=+44 kJ/mol
試寫出H2還原CO2生成CH4和H2O(g)的熱化學方程式_____。
(2)CO2在CuZnO催化下,可同時發(fā)生如下的反應I、II,其可作為解決溫室效應及能源短缺的重要手段。
I.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH1=-57.8kJ/mol
CH3OH(g)+H2O(g)ΔH1=-57.8kJ/mol
II.CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH2=+41.2kJ/mol
CO(g)+H2O(g)ΔH2=+41.2kJ/mol
對于氣體參加的反應,表示平衡常數Kp時,用氣體組分(B)的平衡分壓p(B)代替該氣體的平衡濃度c(B),則反應II的Kp=_____[已知:氣體各組分的分壓p(B),等于總壓乘以其體積分數]。
在CuZnO存在的條件下,保持溫度T不變,在一剛性密閉容器中,充入一定量的CO2及H2,起始及達平衡時,容器內各氣體物質的量如下表:
CO2 | H2 | CH3OH | CO | H2O(g) | 總壓/kPa | |
起始/mol | 5.0 | 7.0 | 0 | 0 | 0 | p0 |
平衡/mol | n1 | n2 | p |
若反應I、II均達平衡時,p0=1.2p,則表中n1/span>=_____;若此時n2=3.則反應I的平衡常數Kp=_____(無需帶單位,用含總壓p的式子表示)。
(3)汽車尾氣是霧霾形成的原因之一,研究氮氧化物的處理方法可有效減少霧霾的形成。可采用氧化還原法脫硝:4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g)ΔH<0
4N2(g)+6H2O(g)ΔH<0
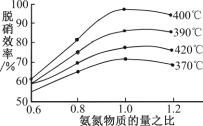
(4)根據圖示判斷提高脫硝效率的最佳條件是_____;氨氮比一定時,在400℃時,脫硝效率最大,其可能的原因是_____。用活性炭還原法也可以處理氮氧化物,某研究小組向某密閉容器加入一定量的活性炭和NO,發(fā)生反應:C(s)+2NO(g)![]() N2(g)+CO2(g)ΔH>0在T℃時,反應進行到不同時間測得各物質的量濃度如下:
N2(g)+CO2(g)ΔH>0在T℃時,反應進行到不同時間測得各物質的量濃度如下:
時間/min | 0 | 10 | 20 | 30 | 40 | 50 |
c(NO)/molL1 | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
c(N2)/molL1 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
c(CO2)/molL1 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
30min后,只改變某一條件,根據上表的數據判斷改變的條件可能是______填字母)。
A.通入一定量的 CO2 B.加入合適的催化劑 C.適當縮小容器的體積
D.通入一定量的 NO E.加入一定量的活性炭 F.適當升高溫度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.中和熱測定實驗中需要的玻璃儀器有:燒杯、量筒、溫度計、環(huán)形玻璃攪拌棒
B.乙烯的燃燒熱為1411.3 kJ·mol1,則乙烯燃燒的熱化學方程式為C2H4(g)+3O2(g)![]() 2CO2(g)+2H2O(g) ΔH= 1411.3 kJ·mol1
2CO2(g)+2H2O(g) ΔH= 1411.3 kJ·mol1
C.用石墨電極電解1 L 0.1 mol·L1 CuSO4溶液,若反應產生0.1 mol O2,則向原溶液中加入0.2 mol CuO能恢復至原濃度
D.用pH試紙分別測定氯水和鹽酸的pH,比較兩溶液的酸性強弱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】醋酸是日常生活中最常見的調味劑和重要的化工原料,醋酸鈉是其常見的鹽(已知:25℃,Ka(CH3COOH)=1.69×10-5)。
(1)醋酸鈉溶液呈堿性的原因是_______________(寫出有關的離子方程式)
(2)在CH3COONa溶液中離子濃度由大到小的順序為_____________________(用c(Bn+)表示相應離子濃度);
(3)25℃時,0.10mol/L的醋酸溶液的pH約為___________(已知:lg1.3=0.114);
(4)對于醋酸溶液和醋酸鈉溶液的下列說法正確的是____________;
A.稀釋醋酸溶液,醋酸的電離程度增大,而稀釋醋酸鈉溶液則醋酸鈉的水解程度減小.
B.升高溫度可以促進醋酸電離,也可以促進醋酸鈉水解.
C.醋酸和醋酸鈉混合液中,醋酸抑制醋酸鈉的水解、醋酸鈉也抑制醋酸的電離.
D.醋酸和醋酸鈉混合液中,醋酸促進醋酸鈉的水解、醋酸鈉也促進醋酸的電離.
(5)物質的量濃度均為0.1mol/L的CH3COONa和CH3COOH溶液等體積混合(注:混合前后溶液體積變化忽略不計),混合液中的下列關系式正確的是_______;
A.c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.1mol/L
(6)常溫時,有以下3種溶液,其中pH最小的是____________;
A.0.02molL-1CH3COOH與0.02molL-1NaOH溶液等體積混合液
B.0.03molL-1CH3COOH與0.01molL-1NaOH溶液等體積混合液
C.pH=2的CH3COOH與pH=12的NaOH溶液等體積混合液
(7)用pH試紙在常溫下分別測定0.10mol/L的醋酸鈉溶液和0.10mol/L的碳酸鈉溶液,則pH(CH3COONa)_______ pH(Na2CO3).(填:“>”、“<”或“=”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鹽酸和氫氧化鈉是工業(yè)上重要的化工原料,也是實驗室里常見的化學試劑。欲測定某NaOH溶液的物質的量濃度,可用0.1000 mol·L-1 HCl標準溶液進行中和滴定(用酚酞作指示劑)。請回答下列問題:
(1)滴定時,盛裝待測NaOH溶液的儀器名稱為_____。
(2)堿式滴定管用蒸餾水洗凈后,接下來應該進行的操作是_________。
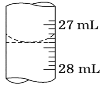
(3)若甲學生在實驗過程中,記錄滴定前滴定管內液面讀數為0.50 mL,滴定后液面如圖,則此時消耗標準溶液的體積為_____。
乙學生做了三組平行實驗,數據記錄如下:
實驗序號 | 待測NaOH溶液的體積/mL | 0.1000mol·L-1HCl溶液的體積/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.11 | 25.10 |
2 | 25.00 | 1.56 | 33.30 |
3 | 25.00 | 0.21 | 25.22 |
(4)選取上述合理數據,計算出待測NaOH溶液的物質的量濃度為______(保留四位有效數字)。
(5)下列哪些操作會使測定結果偏高_____ (填序號)。
A.錐形瓶用蒸餾水洗凈后再用待測液潤洗
B.酸式滴定管用蒸餾水洗凈后再用標準液潤洗
C.滴定前酸式滴定管尖端氣泡未排除,滴定后氣泡消失
D.滴定前讀數正確,滴定后俯視滴定管讀數
(6)滴定達到終點的標志是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】足量銅與一定量濃硝酸反應,得到硝酸銅溶液和NO2、NO的混合氣體4.48L(氣體體積均在標準狀況下測定,下同),這些氣體與一定體積氧氣混合后通入水中,所有氣體完全被水吸收生成硝酸,若向所得硝酸銅溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,消耗NaOH溶液的體積是60mL。下列說法不正確的是![]()
![]()
A.此反應過程中轉移的電子為0.6mol
B.消耗氧氣的體積是1.68L
C.混合氣體中含NO23.36L
D.參加反應的硝酸是0.5mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在剛性容器中發(fā)生反應:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g),一定壓強下,平衡時H2的轉化率α(H2)隨溫度T、投料比
C2H5OH(g)+3H2O(g),一定壓強下,平衡時H2的轉化率α(H2)隨溫度T、投料比![]() 的變化關系如圖所示。下列說法錯誤的是
的變化關系如圖所示。下列說法錯誤的是
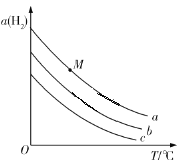
A.投料比![]() 的大小關系是:a>b>c
的大小關系是:a>b>c
B.圖中M點對應的平衡,若容積不變,充入He,則α(H2)不變
C.該反應的平衡常數K(600 ℃)>K(500 ℃)
D.若題圖表示相同投料時,不同壓強下α(H2)隨T的變化關系,則壓強最大的是a
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用如圖裝置進行實驗,1小時后觀察到生鐵明顯銹蝕,由此得出的結論是
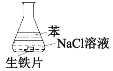
A.屬于化學腐蝕
B.O2未參與反應
C.負極反應2Fe-6e+3H2O→Fe2O3+6H+
D.正極反應O2+4e- +2H2O→4OH-
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com