
【題目】據(jù)媒體報(bào)道,法國一家公司 Tiamat 日前研發(fā)出比當(dāng)前廣泛使用的鋰電池成本更低、壽命更長、充電速度更快的鈉離子電池,預(yù)計(jì)從 2020 年開始實(shí)現(xiàn)工業(yè)生產(chǎn)。該電池的負(fù)極材料為 Na2Co2TeO6(制備原料為 Na2CO3、Co3O4和TeO2),電解液為 NaClO4 的碳酸丙烯酯溶液。 回答下列問題:
(1)Te 屬于元素周期表中______區(qū)元素,其基態(tài)原子的價(jià)電子排布式為______。
(2)基態(tài) Na 原子中,核外電子占據(jù)的原子軌道總數(shù)為______,最高能層電子云輪廓圖形狀為______。
(3)結(jié)合題中信息判斷:C、O、Cl 的電負(fù)性由大到小的順序?yàn)?/span>______ (用元素符號表示)。
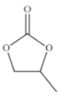
(4)CO32-的幾何構(gòu)型為______;碳酸丙烯酯的結(jié)構(gòu)簡式如圖所示,則其中碳原子的雜化軌道類型為______,1mol 碳酸丙烯酯中σ鍵的數(shù)目為______。
(5)[Co(H2O)6]3+的幾何構(gòu)型為正八面體形,配體是______,該配離子包含的作用力為______ (填選項(xiàng)字母)。
A.離子鍵 B.極性鍵 C.配位鍵 D.氫鍵 E.金屬鍵
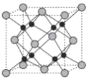
(6)Na 和 O 形成的離子化合物的晶胞結(jié)構(gòu)如圖所示,晶胞中 O 的配位數(shù)為______,該晶胞的密度為ρg/cm3,阿伏加德羅常數(shù)的值為 NA,則Na與O之間的最短距離為______cm(用 ρ、NA 的代數(shù)式表示)。
【答案】p 5s25p4 6 球形 O>Cl>C 平面三角形 sp2、sp3 13NA H2O BC 8 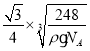
【解析】
(1) 碲(Te)與氧同族,是第VIA族元素,根據(jù)推算位置是第五周期第VIA族,屬于p區(qū)元素;
(2)基態(tài)鈉原子的核外電子排布式是:![]() ,共有4個(gè)能級6個(gè)軌道,最高能層是3s能級,電子云輪廓圖為球形;
,共有4個(gè)能級6個(gè)軌道,最高能層是3s能級,電子云輪廓圖為球形;
(3)根據(jù)元素周期律,同周期從左到右,同族從下至上電負(fù)性均增大,氧與氯在形成化合物時(shí)氧元素顯負(fù)價(jià),吸引電子能力更強(qiáng),故電負(fù)性:O>Cl>C;
(4)CO32-中中心原子的價(jià)層電子對數(shù)是![]() ,不含有孤對電子,采取sp2雜化,是平面三角形構(gòu)型;根據(jù)結(jié)構(gòu)簡式可知,碳形成單鍵、雙鍵兩種化學(xué)鍵,故碳原子采取sp2、sp3雜化;根據(jù)碳原子的成鍵結(jié)構(gòu),周圍滿足四鍵,故1mol 碳酸丙烯酯中σ鍵的數(shù)目為13NA;
,不含有孤對電子,采取sp2雜化,是平面三角形構(gòu)型;根據(jù)結(jié)構(gòu)簡式可知,碳形成單鍵、雙鍵兩種化學(xué)鍵,故碳原子采取sp2、sp3雜化;根據(jù)碳原子的成鍵結(jié)構(gòu),周圍滿足四鍵,故1mol 碳酸丙烯酯中σ鍵的數(shù)目為13NA;
(5)根據(jù)配位化合物的結(jié)構(gòu)可知,該物質(zhì)的配體是:H2O,該配離子包含的作用力有氫氧極性鍵、配位鍵;答案選BC。
(6)根據(jù)原子半徑大小,可判斷出氧離子半徑大于鈉離子半徑,鈉位于內(nèi)部,氧位于頂點(diǎn)和面心,以面心的氧為例,可以直接和8個(gè)鈉相連,故氧的配位數(shù)是8;該物質(zhì)的化學(xué)式為:Na2O,晶胞的體積為:![]() cm3,則晶胞邊長是:
cm3,則晶胞邊長是: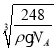 cm,則Na與O之間的最短距離為
cm,則Na與O之間的最短距離為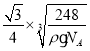 cm。
cm。



| 年級 | 高中課程 | 年級 | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來源: 題型:
【題目】(1)將Cl2通入水中,Cl2部分與水反應(yīng):Cl2+H2![]() OH++Cl-+HClO。若要減少Cl2的溶解,可在氯水中加入少量___。
OH++Cl-+HClO。若要減少Cl2的溶解,可在氯水中加入少量___。
A.AgNO3晶體 B.CaCO3粉末 C.NaCl晶體 D.蒸餾水 E.濃鹽酸
(2)在一定條件下,同時(shí)加入CO、H2O(g)、CO2、H2于一密閉容器中發(fā)生如下反應(yīng):CO+H2O(g)![]() CO2+H2,反應(yīng)開始時(shí)向右進(jìn)行。下列說法中不正確的是___。
CO2+H2,反應(yīng)開始時(shí)向右進(jìn)行。下列說法中不正確的是___。
A.反應(yīng)開始時(shí),正反應(yīng)速率大于逆反應(yīng)速率
B.反應(yīng)開始時(shí),正反應(yīng)速率最大,逆反應(yīng)速率為零
C.隨著反應(yīng)的進(jìn)行,正反應(yīng)速率逐漸減小,最后為零
D.隨著反應(yīng)的進(jìn)行,逆反應(yīng)速率增大,正反應(yīng)速率減小,最后相等
(3)一定條件下(溫度恒定),SO2與O2反應(yīng)的濃度隨時(shí)間的變化如下表。
時(shí)間/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
c(SO2)/(mol·L-1) | 1.0 | |||||||
c(O2)/(mol·L-1) | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
c(SO3)/(mol·L-1) | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
由上表數(shù)據(jù)計(jì)算:
A.30~40min時(shí)間段,以SO2表示的反應(yīng)速率為___;
B.該溫度下,正反應(yīng)的平衡常數(shù)的值為___;
C.平衡時(shí),SO2的轉(zhuǎn)化率為___。
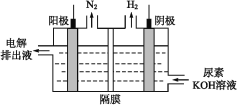
(4)電解尿素的堿性溶液制氫氣的裝置示意圖見如圖(電解池中隔膜僅阻止氣體通過,陰、陽極均為惰性電極)。電解時(shí),陽極的電極反應(yīng)式為___。
(5)3.04g銅鎂合金完全溶解于100mL密度為1.40g·cm-3、質(zhì)量分?jǐn)?shù)為63%的硝酸中,得到NO2氣體2688mL(標(biāo)準(zhǔn)狀況),向反應(yīng)后的溶液中加入1.0mol·L-1NaOH溶液,當(dāng)金屬離子全部沉淀時(shí),得到5.08g沉淀。則加入NaOH溶液的體積是___mL。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】下列說法不正確的是
A.可直接根據(jù)Ksp的數(shù)值大小比較難溶物在水中的溶解度
B.AgCl易轉(zhuǎn)化為AgI沉淀且K(AgX)=c(Ag+)·c(X-),故K(AgI)<K(AgCl)
C.向AgCl、AgBr的飽和溶液中加入少量AgNO3,溶液中![]() 不變
不變
D.常溫下,向Mg(OH)2飽和溶液中加入NaOH固體,Mg(OH)2的Ksp不變
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】在含有Ag+的酸性溶液中,以鐵銨礬NH4Fe(SO4)2作指示劑,用KSCN的標(biāo)準(zhǔn)溶液滴定Ag+.已知:AgSCN(白色s)![]() Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-
Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-![]() [Fe(SCN)] 2+(紅色),K=138。下列說法不正確的是( )
[Fe(SCN)] 2+(紅色),K=138。下列說法不正確的是( )
A. 邊滴定,邊搖動(dòng)溶液,溶液中首先析出AgSCN白色沉淀
B. 當(dāng)Ag+定量沉淀后,少許過量的SCN-與Fe3+生成紅色配合物,即為終點(diǎn)
C. 上述實(shí)驗(yàn)可用KCl標(biāo)準(zhǔn)溶液代替KSCN的標(biāo)準(zhǔn)溶液滴定Ag+
D. 滴定時(shí),必須控制溶液一定的酸性,防止Fe3+水解,影響終點(diǎn)的觀察
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】用煤油作溶劑,二(2-乙基己基)磷酸酯作流動(dòng)載體,H2SO4 作內(nèi)相酸處理含銅廢水。 在其他條件相同時(shí),Cu2+萃取率[萃取率= ×100% ]與初始 Cu2+濃度關(guān)系如圖 1 所示;在其他條件相同時(shí),處理前初始 Cu2+濃度為 200 mg·L-1,Cu2+萃取率與廢水 pH 的關(guān)系如圖 2 所示。下列說法錯(cuò)誤的是
×100% ]與初始 Cu2+濃度關(guān)系如圖 1 所示;在其他條件相同時(shí),處理前初始 Cu2+濃度為 200 mg·L-1,Cu2+萃取率與廢水 pH 的關(guān)系如圖 2 所示。下列說法錯(cuò)誤的是
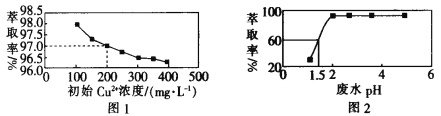
A.根據(jù)圖 1 可知,廢水中初始 Cu2+濃度越大,Cu2+的萃取效果越好
B.根據(jù)圖 2 可知,廢水初始 pH>2 時(shí),去除 Cu2+的效果較好
C.根據(jù)圖 1 可知,Cu2+初始濃度為 200 mg·L-1 時(shí),Cu2+的萃取率為 97.0%
D.根據(jù)圖 2 可知,若取 800 mL 初始 Cu2+濃度為 200 mg·L-1 的廢水,在 pH=1.5 時(shí)處理廢水,則處理后的廢水中剩余 Cu2+的物質(zhì)的量為 1.5×10-3mol(假設(shè)體積不變)
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】將NaCl溶液滴在一塊光亮清潔的鐵板表面上,一段時(shí)間后發(fā)現(xiàn)液滴覆蓋的圓圈中心區(qū)(a)已被腐蝕而變暗,在液滴外沿形成棕色鐵銹環(huán)(b),如圖所示。導(dǎo)致現(xiàn)象的主要原因是液滴之下氧氣含量比邊緣處少。下列說法正確的是( )
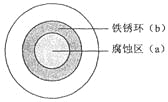
A.液滴中的Cl–由a區(qū)向b區(qū)遷移
B.液滴邊緣是正極區(qū),發(fā)生的電極反應(yīng)為:O2+2H2O+4e-=4OH-
C.液滴下的Fe因發(fā)生還原反應(yīng)而被腐蝕,生成的Fe2+由a區(qū)向b區(qū)遷移,與b區(qū)的OH形成Fe(OH)2,進(jìn)一步氧化、脫水形成鐵銹
D.若改用嵌有一銅螺絲釘?shù)蔫F板,在銅鐵接觸處滴加NaCl溶液,則負(fù)極發(fā)生的電極反應(yīng)為:Cu-2e-=Cu2+
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】鎳及其化合物在工業(yè)生產(chǎn)和科研領(lǐng)域有重要的用途。請回答下列問題:
(1)基態(tài) Ni 原子中,電子填充的能量最高的能級符號為_________,價(jià)層電子的軌道表達(dá)式為_________。
(2)Ni的兩種配合物結(jié)構(gòu)如圖所示:
A B
①A 的熔、沸點(diǎn)高于B的原因?yàn)?/span>_________。
②A晶體含有化學(xué)鍵的類型為___________(填選項(xiàng)字母)。
A.σ鍵 B.π鍵 C.配位鍵 D.金屬鍵
③A晶體中N原子的雜化形式是_________。
(3) 人工合成的砷化鎳常存在各種缺陷,某缺陷砷化鎳的組成為Ni1.2As, 其中 Ni 元素只有+2 和+3 兩種價(jià)態(tài), 兩種價(jià)態(tài)的鎳離子數(shù)目之比為_________。
(4) NiAs的晶胞結(jié)構(gòu)如圖所示:

①鎳離子的配位數(shù)為_________。
②若阿伏加德羅常數(shù)的值為NA,晶體密度為 ρ g·cm-3,則該晶胞中最近的砷離子之間的距離為_________pm。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】常溫下,HNO2的電離常數(shù)Ka=7.1×10-4,NH3·H2O的電離常數(shù)Kb=1.7×10-5。0.1 mol·L-1 NH4NO2溶液中,離子濃度由大到小的順序是__________,常溫下NO2-水解反應(yīng)的平衡常數(shù)Kh=_______(保留兩位有效數(shù)字)。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】一定溫度下,探究銅與稀HNO3的反應(yīng)過程如圖:
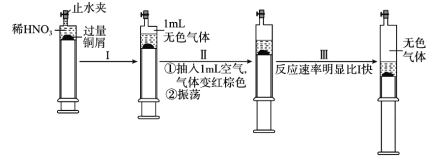
下列說法不正確的是( )
A.過程I中生成無色氣體的離子方程式是3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
B.步驟III反應(yīng)速率比I快的原因是NO2溶于水,使c(HNO3)增大
C.由實(shí)驗(yàn)可知,NO2對該反應(yīng)具有催化作用
D.當(dāng)活塞不再移動(dòng)時(shí),打開止水夾,滴加稀硫酸,銅可以繼續(xù)溶解
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺 | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com