
| A. | ①③⑤⑥ | B. | ②④⑤⑦ | C. | 只有⑤ | D. | 均不對 |
分析 ①電解質的強弱和物質的溶解性之間沒有必然的聯系;
②FeCl3+3KSCN?Fe(SCN)3+3KCl平衡的移動和氯離子濃度之間沒有關系;
③根據反應自發進行的判據△H-T△S<0來判斷;
④活化分子之間的碰撞不一定為有效碰撞,要有一定的取向;
⑤熔融的電解質都能導電
⑥勒夏特列原理用于判斷可逆反應是否達到平衡狀態.
⑦給體系加壓(壓縮),活化分子百分數不變.
解答 解:①電解質的強弱和物質的溶解性之間沒有必然的聯系,不溶于水的鹽(CaCO3、BaSO4等)在熔融狀態下都完全電離,都是強電解質,故錯誤;
②FeCl3+3KSCN?Fe(SCN)3+3KCl平衡的移動和氯離子濃度之間沒有關系,加入少量KCl固體,溶液顏色不變,故錯誤;
③反應自發進行的判據△H-T△S<0,反應4A (g)+B(g)═2C(g)+D(g)△S<0,反應不能自發進行,△H大于零時,低溫下不自發,故錯誤;
④活化分子之間的碰撞不一定為有效碰撞,當發生化學反應的碰撞才是有效碰撞,故錯誤;
⑤熔融的電解質不一定都能導電,如HCl在熔融狀態下不導電,故錯誤;
⑥勒夏特列原理用于判斷可逆反應達到平衡狀態在外界條件的改變下是否會發生移動,故錯誤;
⑦給體系加壓(壓縮),活化分子百分數不變,但濃度增大,反應速率增大,故錯誤;
故選D.
點評 本題考查綜合考查化學平衡的影響因素、強弱電解質的概念,為高頻考點,側重于雙基的考查,題目難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
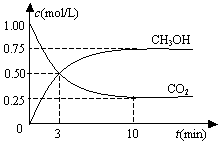 在一恒溫恒容密閉容器中充入1mol CO2和3mol H2,一定條件下發生反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol
在一恒溫恒容密閉容器中充入1mol CO2和3mol H2,一定條件下發生反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol| A. | 反應進行到3 min時,該反應達到平衡狀態 | |
| B. | 從反應開始到平衡,CO2的轉化率為25% | |
| C. | 第3 min時,氫氣的平均反應速率為1.5mol/(L•min) | |
| D. | 該溫度下,反應的平衡常數的值為$\frac{16}{3}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
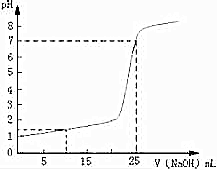 常溫下,將一定濃度的NaOH溶液逐滴加入到20.00mL一定物質的量濃度的硫酸溶液中,反應過程中溶液pH和所加NaOH溶液的體積關系如圖所示:
常溫下,將一定濃度的NaOH溶液逐滴加入到20.00mL一定物質的量濃度的硫酸溶液中,反應過程中溶液pH和所加NaOH溶液的體積關系如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加催化劑同時升高溫度 | B. | 升高溫度同時充入N2 | ||
| C. | 加催化劑同時增大壓強 | D. | 降低溫度同時減小壓強 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 丙烯分子有7個σ鍵,1個π鍵 | |
| B. | 丙烯分子中的碳原子有sp3和sp2兩種雜化類型 | |
| C. | 丙烯分子的所有原子共平面 | |
| D. | 丙烯分子中3個碳原子在同一直線上 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 容器 | 甲 | 乙 | 丙 | |
| 起始反應物投入量 | 2molH2(g) 1molCO(g) | 1mol CH3OH(g) | 2mol CH3OH(g) | |
| 平衡 | c(CH3OH)/mol/•L-1 | c1 | c2 | c3 |
| 反應的能量變化/KJ | Q1 | Q2 | Q3 | |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 溫度/℃ | 800 | 1000 | 1100 | 1200 | 1400 |
| 平衡常數 | 0.45 | 1.92 | 48.1 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com