
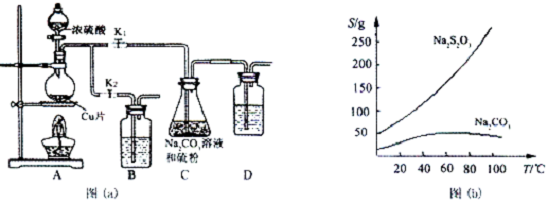
分析 (1)步驟1:利用氣體熱脹冷縮性質,檢驗裝置氣密性;
步驟2:裝置B、D的作用是進行尾氣處理,防止尾氣中二氧化硫污染空氣;
步驟3:硫代硫酸鈉在酸性溶液中不穩定,應控制溶液為弱堿性,即控制溶液pH接近或不小于7;
步驟4:從溶液中獲得晶體,需要加熱濃縮,趁熱過濾,再將濾液冷卻結晶、過濾、洗滌、烘干,得到產品;
(2)由題目信息可知,Na2S2O3被氯水氧化反應生成Na2SO4、H2SO4,氯氣被還原為HCl;
(3)由題意可知,BaCrO4用鹽酸溶解轉化為Cr2O2-7,由元素守恒及已知方程式可得關系式:2Ba2+~2BaCrO4~Cr2O2-7~3I2~6Na2S2O3,結合消耗的Na2S2O3利用關系式計算溶液中n(Ba2+),進而計算c(Ba2+).
解答 解:(1)步驟1:利用氣體熱脹冷縮性質,檢驗裝置氣密性,具體操作為:故答案為:關閉K2打開K1,在D中加水淹沒導管末端,用熱毛巾或雙手捂住燒瓶,D中導管有氣泡冒出,冷卻后形成1段水柱,說明氣密性良好,
步驟2:裝置B、D的作用是進行尾氣處理,防止尾氣中二氧化硫污染空氣,二氧化硫具有還原性,可以用酸性高錳酸鉀溶液氧化吸收,二氧化硫能與氫氧化鈉溶液、碳酸氫鈉溶液反應被吸收,故選:ACD;
步驟3:硫代硫酸鈉在酸性溶液中不穩定,應控制溶液為弱堿性,可以控制溶液pH接近或不小于7,
步驟4:從溶液中獲得晶體,需要加熱濃縮,趁熱過濾,再將濾液冷卻結晶、過濾、洗滌、烘干,得到產品,
故答案為:關閉K2打開K1,在D中加水淹沒導管末端,用熱毛巾或雙手捂住燒瓶;ACD;pH接近或不小于7;硫代硫酸鈉在酸性溶液中不穩定;冷卻結晶、洗滌;
(2)由題目信息可知,Na2S2O3被氯水氧化反應生成Na2SO4、H2SO4,氯氣被還原為HCl,反應方程式為:Na2 S2O3+4Cl2+5H2O=Na2SO4+H2SO4+8HCl,
故答案為:Na2 S2O3+4Cl2+5H2O=Na2SO4+H2SO4+8HCl;
(3)由題意可知,BaCrO4用鹽酸溶解轉化為Cr2O2-7,由元素守恒及已知方程式可得關系式:2Ba2+~2BaCrO4~Cr2O2-7~3I2~6Na2S2O3,消耗的Na2S2O3為0.018L×0.01mol/L,則n(Ba2+)=0.018L×0.01mol/L×$\frac{1}{3}$=0.00006mol,故溶液中c(Ba2+)=$\frac{0.00006mol}{0.025L}$=0.0024mol/L,
故答案為:0.0024mol/L.
點評 本題考查實驗制備方案設計,涉及氣密性檢驗、對實驗裝置及步驟的分析評價、物質的分離提純、氧化還原反應滴定,(3)中注意利用關系式進行計算,難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 2.8mol/L | B. | 3.0mol/L | C. | 3.2mol/L | D. | 3.6mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 ,打破1mol P-Cl鍵吸收b kJ的熱量,打破1mol Cl-Cl鍵吸收c kJ的熱量.下列敘述正確的是( )
,打破1mol P-Cl鍵吸收b kJ的熱量,打破1mol Cl-Cl鍵吸收c kJ的熱量.下列敘述正確的是( )| A. | 1 mol P4(g)和1 mol Cl2(g)所具有的能量和大于1 mol PCl3(g) 所具有的能量 | |
| B. | 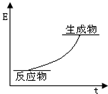 該反應的能量圖象可表示 該反應的能量圖象可表示 | |
| C. | 形成1mol P-P鍵放出-($\frac{a}{6}$-2b+c) kJ的熱量 | |
| D. | 因為該反應為放熱反應,故不需要任何條件就能快速進行 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | ①③④ | B. | ②④ | C. | ①③⑤ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 石油裂解的主要目的是提高汽油等輕質油的產量與質量,石油催化裂化的主要目的是得到更多的乙烯、丙烯等氣態短鏈烴 | |
| B. | 分子式為C3H7C1的有機物有三種同分異構體 | |
| C. | 甲烷、苯、乙醇、乙酸和乙酸乙酯在一定條件下都能發生取代反應 | |
| D. | 向蛋白質溶液中加入濃的Na2SO4或CuSO4溶液均可使蛋白質鹽析而分離提純 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氣態氫化物的穩定性:D>W | |
| B. | 四種元素一定屬于短周期元素 | |
| C. | 最高價氧化物對應水化物的堿性:L>K | |
| D. | 原子序數:L>K>W>D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| A元素的核外電子數和電子層數相等 |
| B元素原子的核外p電子數比s電子數少1 |
| C原子的第一至第四電離能如下: |
| I1=738kJ•mol-1 I2=1 451kJ•mol-1 I3=7 733kJ•mol-1 I4=10 540kJ•mol-1 |
| D原子核外所有p軌道全滿或半滿 |
| E元素的主族序數與周期數的差為4 |
| F是前四周期中電負性最小的元素 |
| G在周期表的第七列 |
 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 隨著原子序數的遞增,第三周期元素的電負性逐漸減小 | |
| B. | 鋁的第一電離能比鎂的第一電離能大 | |
| C. | K、Na、Li的第一電離能逐漸增大 | |
| D. | 電負性差值大的元素原子之間形成的化學鍵主要是共價鍵 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com