
【題目】CS2是一種常見溶劑,還可用于生產人造粘膠纖維等。回答下列問題:
(1)CS2與酸性KMnO4溶液反應,產物為CO2和硫酸鹽,該反應中還原劑與氧化劑的物質的量之比為__________(MnO4-被還原為Mn2+)。
(2)甲烷硫磺法制取CS:的反應為CH4(g)+2S2(g)![]() CS2(g)+2H2S(g) △H
CS2(g)+2H2S(g) △H
①在恒溫恒容密閉容器中進行該反應時,能說明該反應已達到平衡狀態的是_________(填字母)。
A.v正(S2)=2v逆(CS2)
B.容器內氣體的密度不再隨時間變化
C.容器內氣體的總壓強不再隨時間變化
D.單位時間內斷裂C-H鍵數目與斷裂H-S鍵數目相等
②已知下列鍵能數據:
共價鍵 | C-H | S=S | C=S | H-S |
鍵能/ | 411 | 425 | 573 | 363 |
該反應的△H=_________kJ·mol-1。
(3)在一密閉容器中,起始時向該容器中充入H2S和CH4且n(H2S):n(CH4)=2:1,發生反應:CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)。0.1MPa時,溫度變化對平衡時產物的物質的量分數的影響如圖所示:
CS2(g)+4H2(g)。0.1MPa時,溫度變化對平衡時產物的物質的量分數的影響如圖所示:
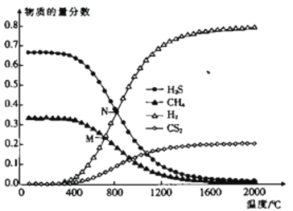
①該反應△H_________(填“>”或“<”)0。
②M點對應溫度下,H2S的平衡轉化率為_________,為提高H2S的平衡轉化率,除改變溫度外,還可采取的措施是___________________________(列舉一條)。
③N點,平衡分壓p(CS2)=_________MPa,對應溫度下,該反應的Kp=_________(MPa)2。(Kp為以分壓表示的平衡常數)
【答案】5:16 AD -104 > 20% 減小起始時![]()
![]()
![]()
【解析】
(1)根據題意,CS2被氧化為硫酸鹽,每個S的化合價由-2價升至+6價,轉移電子數為8,2個S轉移電子數為16,MnO4-被還原為Mn2+,每個Mn轉移電子數為5,根據氧化還原反應轉移電子數守恒,還原劑(CS2)與氧化劑(MnO4-)的物質的量之比為5:16;
(2)①A.v正(S2)=2v逆(CS2),反應速率符合化學計量數之比,且既有正反應方向又有逆反應方
向,A正確;
B.氣體的密度![]() ,反應物和生成物都是氣體,根據質量守恒,m為定值,容器體積固定,V不變,故
,反應物和生成物都是氣體,根據質量守恒,m為定值,容器體積固定,V不變,故![]() 是個定值,不能用來判定化學平衡,B錯誤;
是個定值,不能用來判定化學平衡,B錯誤;
C.由于反應CH4(g)+2S2(g)![]() CS2(g)+2H2S(g)前后氣體體積不變,故容器中的壓強也不變,所以壓強不能用來判定平衡,C錯誤;
CS2(g)+2H2S(g)前后氣體體積不變,故容器中的壓強也不變,所以壓強不能用來判定平衡,C錯誤;
D.斷裂C-H鍵是正反應方向,斷裂H-S鍵是逆反應方向,CH4與H2S計量數之比為1:2,化學鍵數目之比為1:1,單位時間內斷裂C-H鍵數目與斷裂H-S鍵數目相等,說明反應速率符合系數比,D正確;
故選AD。
②焓變可以用反應物的總鍵能減去生成物的總鍵能來計算,![]() ;
;
(3)①由圖像可知,溫度升高時,平衡向正向移動,故正反應吸熱,![]() >0;
>0;
②設開始時投入的CH4的物質的量為![]() ,H2S的物質的量為2
,H2S的物質的量為2![]() ,反應的CH4的物質的量為
,反應的CH4的物質的量為![]() ,則有
,則有
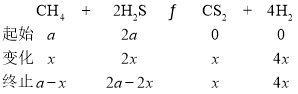
M點時,CH4與H2S物質的量相等,故有![]() ,則H2S轉化率為
,則H2S轉化率為![]() ;增大H2S的轉化率可以提高CH4的投料比,即減小起始時
;增大H2S的轉化率可以提高CH4的投料比,即減小起始時![]() ;
;
③設開始時投入的CH4的物質的量為![]() ,H2S的物質的量為2
,H2S的物質的量為2![]() ,反應的CH4的物質的量為
,反應的CH4的物質的量為![]() ,則有
,則有
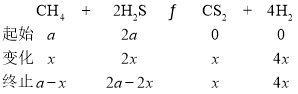
N點時,H2S與H2物質的量相等,故有![]() ,解得
,解得![]() 。所以反應后的總物質的量為
。所以反應后的總物質的量為![]() ,平衡后CS2的分壓為
,平衡后CS2的分壓為![]() ;
;
平衡常數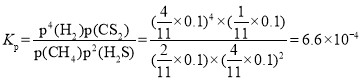 。
。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】下列屬于化合反應的是
A.Zn+2AgNO3=Zn(NO3)2+2AgB.2FeCl2+Cl2=2FeCl3
C.Cu(OH)2+2HCl=CuCl2+2H2OD.CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,CO和水蒸氣分別為1 mol、3 mol,在密閉容器中發生反應CO+H2O(g)![]() CO2+H2,達平衡后測得CO2為0.75 mol,再通入6 mol水蒸氣,達到新的平衡后,CO2和H2的物質的量之和可能為
CO2+H2,達平衡后測得CO2為0.75 mol,再通入6 mol水蒸氣,達到新的平衡后,CO2和H2的物質的量之和可能為
A. 1.2 mol B. 1.8 mol C. 2.5 mol D. 1.5mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】大氣污染越來越成為人們關注的問題,煙氣中的NOx必須脫除(即脫硝)之后才能排放。
(1)CO和H2可作為能源和化工原料,應用十分廣泛。 反應CO(g)+H2O(g) ![]() H2(g)+CO2(g)的平衡常數隨溫度的變化如表所示。
H2(g)+CO2(g)的平衡常數隨溫度的變化如表所示。
溫度/℃ | 400 | 500 | 830 | 1 000 |
平衡常數K | 10 | 9 | 1 | 0.6 |
①從上表可以推斷:此反應是__________(填“吸”或“放”)熱反應。
②在830 ℃下,若開始時向恒容密閉容器中充入CO與H2O均為1 mol,則達到平衡后CO的轉化率為________。
(2)在汽車尾氣系統中裝置催化轉化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ·mol1
2CO2(g) ΔH=566.0 kJ·mol1
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+180.5 kJ·mol1
2NO(g) ΔH=+180.5 kJ·mol1
③2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 kJ·mol1
2NO2(g) ΔH=116.5 kJ·mol1
回答下列問題:
①CO的燃燒熱為 _________。 若1 mol N2(g)、1 mol O2(g) 分子中化學鍵斷裂時分別需要吸收946 kJ、498 kJ的能量,則1 mol NO(g) 分子中化學鍵斷裂時需吸收的能量為_________kJ。
②寫出CO將NO2還原為單質反應的熱化學方程式為__________________________________________
(3)汽車排氣管上的催化轉化器,發生上述的CO將NO2還原為單質反應。在一定溫度下,將一定量的CO和NO2充入2L固定容積的容器中,回答以下問題:
①從反應開始到5min,生成了0.08mol N2,則5min內υ(CO)=___________________molL1min1。
②25min時,物質濃度變化如圖所示,則改變的條件可能是___________(填字母標號)。
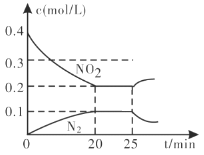
A.縮小容器體積 B.增加NO2的濃度 C.降低溫度 D.升高溫度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知H2(g)+2ICl(g)=I2(g)+2HCl(g),該反應分①、②兩步進行,其能量曲線如圖所示, 已知:ICl中氯為-1價,碘為+1價。下列有關說法正確的是
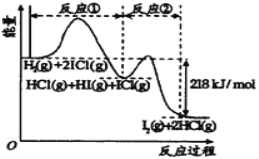
A.反應①為吸熱反應
B.反應①和②均是同種元素間發生的氧化還原反應
C.反應①比反應②的速率慢,與相應正反應的活化能有關
D.HI(g)+ICl(g) ![]() I2(g)+HCl(g) △H=-218 kJ/mol
I2(g)+HCl(g) △H=-218 kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉻礦是冶金、國防、化工等領域不可缺少的礦產資源,其中的鉻鐵礦是唯一可開采的鉻礦石。工業上常用鉻鐵礦(主要含Fe2O3、FeO和Cr2O3,還含有MgO、Al2O3、SiO2等雜質)為原料制備重鉻酸鉀和三氧化二鐵,其流程如圖所示。

已知常見離子開始生成沉淀和沉淀完全的pH如下表所示。

請回答下列問題:
(1)鉻鐵礦與熔融 NaOH 和 NaCIO3的反應是在坩堝中進行的,可用作此坩堝材料的是___________.
A.鎳 B.剛玉(Al2O3) C. 陶瓷 D.石英
(2)寫出鉻鐵礦中的Cr2O3與熔融 NaOH和NaCIO3反應的化學方程式:___。由于在該過程中鐵元素會大量轉變為NaFeO2,所以加水的作用為__________________(用離子方程式表示)。
(3)“濾渣 2”的主要成分為_________(填化學式)。
(4)利用化學平衡移動原理解釋調節pH2約至4.5的原因是;再向其中加入KC1固體,蒸發濃縮至液體表面有晶膜產生,冷卻結晶,過濾得到粗重鉻酸鉀晶體。為獲得高純度重鉻酸鉀晶體,可采取___________(填操作名稱)。
(5)調節pH3的范圍為__________
(6)已知鉻鐵礦中鐵、鉻元素的質量比為14:13.上述流程中鐵元素轉化為Fe2O3的利用率為60%,提取鉻元素的轉化率為90%,如果得到Fe2O3的質量為32t,則可以制備K2Cr2O7的質量為______t(結果保留1位小數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)已知2P4+9KOH+3H2O═3K3PO4+5PH3反應中氧化劑是______; 氧化劑與還原劑物質的量之比是_________;氧化產物是____________。
(2)請用雙線橋法標出下列反應電子轉移的方向和數目10Al+6NaNO3 +4NaOH═10NaAlO2 +3N2↑+2H2O______________________
(3)Mn2+、Bi3+、BiO3﹣、MnO4﹣、H+、H2O組成的一個氧化還原系統中,發生BiO3﹣→Bi3+的反應過程,據此回答下列問題 ①該氧化還原反應中,被還原的元素是____________。
②請將氧化劑、還原劑的化學式及配平后的方程式填入下列相應的位置中,并用單線橋法標出電子轉移的方向和數目_______________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳的化合物在生產、生活中有著重要的作用。
(1)已知:2CO(g)+O2(g)![]() 2CO2(g) △H1=-566kJ·molˉ1
2CO2(g) △H1=-566kJ·molˉ1
H2O(g)+CO(g)![]() H2(g)+CO2(g) △H2=-41kJ·molˉ1
H2(g)+CO2(g) △H2=-41kJ·molˉ1
CO(g)+2H2(g)![]() CH3OH(g) △H3=-107kJ·molˉ1
CH3OH(g) △H3=-107kJ·molˉ1
則CH3OH(g)+![]() O2(g)
O2(g) ![]() CO2(g)+2H2O(g) △H=___kJ·molˉ1
CO2(g)+2H2O(g) △H=___kJ·molˉ1
(2)T℃時,向容積均為2L的A、B兩個密閉容器中均通入4.0molCO2和6.8molH2,發生反應:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-50kJ·molˉ1。A容器中的反應在恒溫、恒容條件下進行;B容器中的反應在恒溫、恒壓條件下進行,測得A容器中CO2的轉化率 α (CO2) 隨時間的變化如圖所示。
CH3OH(g)+H2O(g) △H=-50kJ·molˉ1。A容器中的反應在恒溫、恒容條件下進行;B容器中的反應在恒溫、恒壓條件下進行,測得A容器中CO2的轉化率 α (CO2) 隨時間的變化如圖所示。

①在0~5min內A容器中v(CH3OH)=___;該溫度下上述反應的平衡常數K=___(保留兩位有效數字)。
②反應開始至平衡的過程中,A、B兩容器中CO2的消耗速率的大小關系為v(A)___(填“>”“<”或“=”)v(B)。
③反應過程中,下列各項指標能表明A容器中反應的v正>v逆的是___(填標號)
a.體系內的壓強增大
b.氣體的平均相對分子質量增大
c.斷裂H-H鍵的數目是形成C-O鍵數目的2倍
d.v逆(CO2)=v正(H2)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組的同學為探究二氧化硫的化學性質,設計了如圖所示的裝置。
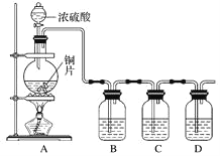
請回答下列問題:
(1)銅和濃硫酸反應的化學方程式為___。
(2)B瓶中盛有品紅溶液,觀察到品紅溶液退色,這是因為SO2具有__(填字母,下同),C瓶中盛有新制的氯水,觀察到氯水退色,這是因為SO2具有__。
A.氧化性 B.還原性 C.漂白性
(3)D瓶中盛有NaOH溶液,作用是___。
(4)充分反應后,小組同學發現銅和硫酸都有剩余。若想使剩余的銅片溶解,可再加入__(填字母)。
A.HNO3 B.NaNO3 C.Fe2O3 D.Na2CO3
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com