(1)18g重水2H2O中含氫原子 個,含電子數為 個.
(2)在無土栽培中,配制只含0.5mol/LNH4+、0.6mol/L Cl-、0.5mol/L K+、 mol/L SO42-的某營養液,若用KCl、(NH4)2 SO4、 配制1L該營養液,則需這三種固體的物質的量分別為 0.5mol、0.2mol、 mol.
【答案】
分析:(1)根據n=
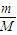
計算18g重水
2H
2O的物質的量,由化學式
2H
2O可知,H原子物質的量是水分子的2倍,根據N=nN
A計算H原子數目;
每個
2H
2O分子含有10個電子,電子物質的量是水分子的10倍,根據N=nN
A計算電子數目;
(2)根據溶液中電荷守恒可知,溶液中c(NH
4+)+c(K
+)=c(Cl
-)+2c(SO
42-),據此計算SO
42-的濃度;
根據n=cV計算溶液中NH
4+、Cl
-、K
+、SO
42-的物質的量,計算0.5molKCl、0.2mol(NH
4)
2 SO
4中含有的NH
4+、Cl
-、K
+、SO
42-的物質的量,據此確定缺少的離子及物質的量,進而確定還需要的物質及物質的量.
解答:解:(1)18g重水
2H
2O的物質的量為
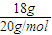
=0.9mol,由化學式
2H
2O可知,n(H)=0.9mol×2=1.8mol,故含有H原子數目為1.8mol×N
Amol
-1=1.8N
A;
每個
2H
2O分子含有10個電子,電子物質的量是水分子的10倍,故n(電子)=0.9mol×10=9mol,故含有電子數目為9mol×N
Amol
-1=9N
A,
故答案為:1.8N
A,9N
A;
(2)根據溶液中電荷守恒可知,溶液中c(NH
4+)+c(K
+)=c(Cl
-)+2c(SO
42-),所以0.5mol/L+0.5mol/L=0.6mol/L+2c(SO
42-),故c(SO
42-)=0.2mol/L;
1L溶液中n(NH
4+)=1L×0.5mol/L=0.5mol,n(Cl
-)=1L×0.6mol/L=0.6mol,n(K
+)=1L×0.5mol/L=0.5mol,n(SO
42-)=1L×0.2mol/L=0.2mol.0.5molKCl中含有n′(K
+)=0.5mol,n′(Cl
-)=0.5mol,0.2mol(NH
4)
2 SO
4中含有的n′(NH
4+)=0.4mol,n′(SO
42-)=0.2mol,故還缺少0.1molNH
4+、0.1molCl
-,故還需要0.1molNH
4Cl,
故答案為:0.2,NH
4Cl,0.1.
點評:考查常用化學計量的有關計算、物質中原子數目的計算等,難度中等,注意利用電荷守恒計算混合溶液中離子濃度.

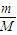 計算18g重水2H2O的物質的量,由化學式2H2O可知,H原子物質的量是水分子的2倍,根據N=nNA計算H原子數目;
計算18g重水2H2O的物質的量,由化學式2H2O可知,H原子物質的量是水分子的2倍,根據N=nNA計算H原子數目;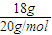 =0.9mol,由化學式2H2O可知,n(H)=0.9mol×2=1.8mol,故含有H原子數目為1.8mol×NAmol-1=1.8NA;
=0.9mol,由化學式2H2O可知,n(H)=0.9mol×2=1.8mol,故含有H原子數目為1.8mol×NAmol-1=1.8NA;

 口算小狀元口算速算天天練系列答案
口算小狀元口算速算天天練系列答案