
【題目】學習小組擬通過實驗,探究Mg(NO3)2受熱分解的產物.
小組猜想:ⅰ.固體產物可能有Mg(NO2)2、MgO、Mg3N2中的一種或幾種
ⅱ.氣體產物可能有NO2、N2、O2中的一種或幾種
查得相關資料:a.Mg(NO2)2、Mg(NO3)2易溶于水,MgO難溶于水.
b.2NO2+2NaOH=NaNO3+NaNO2+H2O
c.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
針對以上猜想,設計了如圖所示實驗(圖中加熱、夾持儀器等裝置均省略):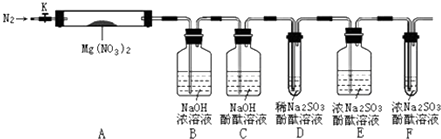
進行實驗
Ⅰ.檢驗上述裝置氣密性.
Ⅱ.稱取3.7gMg(NO3)2固體,置入硬質玻璃管A中,打開K,通入一段時間N2 , 并進行相關物質質量稱量
Ⅲ.關閉K,用酒精燈持續給裝置A加熱,過程中各裝置內溶液均未倒吸入其它裝置.
Ⅳ.待Mg(NO3)2完全分解,裝置冷卻至室溫,打開K,再緩慢通入一會N2后并再稱量.稱得A中剩余固體質量為1.0g,B、C、D、E、F中溶液質量分別增加了2.3g、0.0g、0.1g、0.3g、0.05g.
Ⅴ.取少量剩余固體于試管中,加入適量水,未出現明顯現象.
(1)回答問題
①小組預測一定有O2生成,理由是 .
②N2的電子式是 , 步驟Ⅱ中,通入一段時間N2的目的是 .
③步驟Ⅲ中,裝置A內若出現了紅棕色氣體,其化學式是 .
④裝置C中若紅色始終未褪,其設計的目的是 .
⑤實驗中發現Mg(NO3)2分解時有O2生成,其實驗現象是 , 用化學用語解釋,產生上述現象的原因是 .
⑥實驗中Mg(NO3)2分解沒有N2生成的理由是 .
⑦Mg(NO3)2分解的化學方程式是 .
⑧裝置F中溶液質量增加的原因是 .
【答案】
(1)N元素化合價降低,則一定存在化合價升高的元素,只能為氧元素失去電子生成O2;![]() ;避免對分解產物O2的檢驗產生干擾;NO2;驗證NO2是否被吸收干凈,防止NO2干擾后續對O2的檢驗;C中紅色溶液中有氣泡冒出,D中溶液褪色;Na2SO3+H2ONaHSO3+NaOH、2Na2SO3+O2=2Na2SO4;Mg(NO3)2的質量與剩余固體、NO2、O2的質量之和相等,已符合質量守恒定律;2Mg(NO3)2
;避免對分解產物O2的檢驗產生干擾;NO2;驗證NO2是否被吸收干凈,防止NO2干擾后續對O2的檢驗;C中紅色溶液中有氣泡冒出,D中溶液褪色;Na2SO3+H2ONaHSO3+NaOH、2Na2SO3+O2=2Na2SO4;Mg(NO3)2的質量與剩余固體、NO2、O2的質量之和相等,已符合質量守恒定律;2Mg(NO3)2 ![]() ?MgO+4NO2↑+O2↑;吸收空氣進入的O2所致
?MgO+4NO2↑+O2↑;吸收空氣進入的O2所致
【解析】解:①Mg(NO3)2受熱分解生成的氮化物中,N元素的化合價降低,則一定有化合價升高的元素,根據硝酸鎂的組成可知,只能為﹣2價的氧元素失去電子生成氧氣,故答案為:N元素化合價降低,則一定存在化合價升高的元素,只能為氧元素失去電子生成O2;
②氮氣分子中含有氮氮三鍵,氮原子最外層達到8電子穩定結構,其電子式為: ![]() ;步驟Ⅱ中,通入一段時間N2 , 目的是用氮氣排出裝置中空氣避免對產物氧氣檢驗的干擾,故答案為:
;步驟Ⅱ中,通入一段時間N2 , 目的是用氮氣排出裝置中空氣避免對產物氧氣檢驗的干擾,故答案為: ![]() ;避免對分解產物O2的檢驗產生干擾;
;避免對分解產物O2的檢驗產生干擾;
③步驟Ⅲ中,裝置A內若出現了紅棕色氣體,則該紅棕色氣體為NO2 , 故答案為:NO2;
④裝置D用于檢驗氧氣,而二氧化氮能夠氧化亞硫酸鈉,影響了氧氣的測定,所以必須用裝置C驗證NO2是否被吸收干凈,防止NO2干擾后續對O2的檢驗,故答案為:驗證NO2是否被吸收干凈,防止NO2干擾后續對O2的檢驗;
⑤若裝置C中紅色溶液中有氣泡冒出,且試管D中亞硫酸鈉的酚酞溶液褪色,則證明反應產物中有氧氣,涉及的反應有:亞硫酸鈉水解溶液呈堿性,所以滴有酚酞的溶液顯示紅色:Na2SO3+H2ONaHSO3+NaOH、亞硫酸鈉被氧化生成硫酸鈉:2Na2SO3+O2=2Na2SO4 , 導致溶液褪色,故答案為:C中紅色溶液中有氣泡冒出,D中溶液褪色;Na2SO3+H2ONaHSO3+NaOH、2Na2SO3+O2=2Na2SO4;
⑥稱取3.7gMg(NO3)2固體,反應后剩余1g固體,B中增重2.3g為二氧化氮質量,D、E增重的為氧氣,質量為0.4g,總質量恰好為3.7g,說明反應產物中不會有氮氣生成,
故答案為:Mg(NO3)2的質量與剩余固體、NO2、O2的質量之和相等,已符合質量守恒定律;
⑦取少量剩余固體于試管中,加入適量水,未出現明顯現象,說明反應產物中沒有氮化鎂和亞硝酸鎂,只能為氧化鎂,結合其它分析可知,硝酸鎂分解生成氧化鎂、二氧化氮氣體和氧氣,反應方程式為:2Mg(NO3)2 ![]() 2MgO+4NO2↑+O2↑,
2MgO+4NO2↑+O2↑,
故答案為:2Mg(NO3)2 ![]() 2MgO+4NO2↑+O2↑;
2MgO+4NO2↑+O2↑;
⑧裝置F的作用是吸收空氣中氧氣,避免干擾實驗測定,由于亞硫酸鈉與空氣中氧氣反應生成硫酸鈉,導致試管F中溶液質量增加,故答案為:吸收空氣進入的O2所致.
①根據氧化還原反應中化合價有升高,一定也要降低角度進行判斷;②氮氣分子中含有氮氮三鍵,最外層滿足8電子穩定結構;各裝置中都有氧氣,避免空氣中氧氣干擾實驗;③根據二氧化氮為紅棕色氣體分析;④二氧化氮影響氧氣的檢驗,所以檢驗氧氣前先必須證明二氧化氮已經除盡;⑤若C中紅色溶液中有氣泡冒出,D中溶液褪色,則證明產物中有氧氣;分別寫出亞硫酸鈉水解、亞硫酸鈉被氧氣氧化的方程式;⑥根據質量守恒進行判斷;⑦根據以上分析可知,硝酸鎂分解生成氧化鎂、二氧化氮和氧氣,據此寫出反應的方程式;⑧空氣中有氧氣,能夠將亞硫酸鈉氧化成硫酸鈉導致溶液質量增加.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】某溶液中存在較多的H+、SO42-、NO3-,則該溶液中還可能大量存在的離子組是
A. Mg2+、NH4+、Cl- B. Mg2+、Ba2+、Br-
C. Na+、Cl-、I- D. Al3+、HCO3-、Cl-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下在密閉容器中發生如下反應:2M(g)+N(g)2E(g)若開始時只充入2molE(g),達平衡時,混合氣體的壓強比起始時增大了20%;若開始時只充入2molM和1molN的混合氣體,達平衡時M的轉化率為( )
A.20%
B.40%
C.60%
D.80%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由2﹣氯丙烷為主要原料制取1,2﹣丙二醇CH3CH(OH)CH2OH時,經過的反應為( )
A.加成﹣消去﹣取代
B.取代﹣加成﹣消去
C.取代﹣消去﹣加成
D.消去﹣加成﹣取代
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究性學習小組對過量炭粉與氧化鐵反應的氣體產物成分進行研究.
(1)提出假設
①該反應的氣體產物是CO2 .
②該反應的氣體產物是CO.
③該反應的氣體產物是 .
(2)設計方案
如圖所示,將一定量的氧化鐵在隔絕空氣的條件下與過量炭粉完全反應,測定參加反應的碳元素與氧元素的質量比.
查閱資料
氮氣不與碳、氧化鐵發生反應.實驗室可以用氯化銨飽和溶液和亞硝酸鈉(NaNO2)飽和溶液混合加熱反應制得氮氣.請寫出該反應的離子方程式: .
(3)實驗步驟
①按圖連接裝置,并檢查裝置的氣密性,稱取3.20g氧化鐵、2.00g碳粉混合均勻,放入48.48g的硬質玻璃管中;
②加熱前,先通一段時間純凈干燥的氮氣;
③停止通入N2后,夾緊彈簧夾,加熱一段時間,澄清石灰水(足量)變渾濁;
④待反應結束,再緩緩通入一段時間的氮氣.冷卻至室溫,稱得硬質玻璃管和固體總質量為52.24g;
⑤過濾出石灰水中的沉淀,洗滌、烘干后稱得質量為2.00g.
步驟②、④中都分別通入N2 , 其作用分別為 .
(4)數據處理
試根據實驗數據分析,寫出該實驗中氧化鐵與碳發生反應的化學方程式: .
(5)實驗優化
學習小組有同學認為應對實驗裝置進一步完善.
①甲同學認為:應將澄清石灰水換成Ba(OH)2溶液,其理由是 .
②從環境保護的角度,請你再提出一個優化方案將此實驗裝置進一步完善: .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA表示阿伏加德羅常數的值,下列說法正確的是( ) 
A.5.6 g鐵粉在0.1mol氯氣中充分燃燒,轉移電子數為0.3NA
B.12.5mL 16molL﹣1濃硫酸與足量銅反應,轉移電子數為0.2NA
C.7.8g Na2S和Na2O2的混合物中含有的陰離子數等于0.1NA
D.0.5mol雄黃(As4S4 , 結構如圖)含有NA個S﹣S鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】烏洛托品在合成、醫藥、染料等工業中有廣泛用途,其結構式如圖所示.將甲醛水溶液與氨水混合蒸發可制得烏洛托品.若原料完全反應生成烏洛托品,則甲醛與氨的物質的量之比為( ) 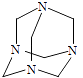
A.1:1
B.2:3
C.3:2
D.2:1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com