
| 溫度/℃ | 700 | 830 | 1200 |
| K值 | 1.7 | 1.0 | 0.4 |
| A. | 4s時,c(B)為0.76 mol•L-1 | |
| B. | 830℃到平衡時,A的轉化率為80% | |
| C. | 達平衡時,升高溫度,平衡正向移動 | |
| D. | 1200℃時反應C(g)+D(g)?A(g)+B(g)的平衡常數的值為0.4 |
分析 A.反應初始4s內A的平均反應速率v(A)=0.005mol/(L•s),則參加反應的A為0.005mol/(L•s)×4s=0.02molL,結合反應可知參加反應的B為0.02mol/L;
B.830℃達平衡時,K=1.0,設轉化的A為x,則
濃度 A(g)+B(g)?C(g)+D(g)
開始 0.1 0.4 0 0
轉化 x x x x
平衡 0.1-x 0.4-x x x
則$\frac{x×x}{(0.1-x)(0.4-x)}$=1,解得x=0.08mol/L;
C.由表格數據可知,溫度越高,K越小;
D.相同溫度下,相反過程的K互為倒數.
解答 解:A.反應初始4s內A的平均反應速率v(A)=0.005mol/(L•s),則參加反應的A為0.005mol/(L•s)×4s=0.02molL,結合反應可知參加反應的B為0.02mol/L,則4 s時c(B)為$\frac{0.8mol}{2L}$-0.02mol/L=0.38 mol/L,故A錯誤;
B.830℃達平衡時,K=1.0,設轉化的A為x,則
濃度 A(g)+B(g)?C(g)+D(g)
開始 0.1 0.4 0 0
轉化 x x x x
平衡 0.1-x 0.4-x x x
則$\frac{x×x}{(0.1-x)(0.4-x)}$=1,解得x=0.08mol/L,則A的轉化率為$\frac{0.08mol/L}{0.1mol/L}$×100%=80%,故B正確;
C.由表格數據可知,溫度越高,K越小,正反應為放熱反應,則升高溫度,平衡逆向移動,故C錯誤;
D.相同溫度下,相反過程的K互為倒數,由1200℃時A(g)+B(g)?C(g)+D(g)的K=0.4,則1200℃時反應C(g)+D(g)?A(g)+B(g)的平衡常數為$\frac{1}{0.4}$=2.5,故D錯誤;
故選B.
點評 本題考查化學平衡的計算,為高頻考點,把握化學平衡三段法、轉化率及速率計算、K的計算等為解答的關鍵,側重分析與計算能力的考查,注意表格數據的應用,題目難度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 氯酸鉀是還原劑 | |
| B. | KCl既是氧化產物,又是還原產物 | |
| C. | 反應中消耗3mol P時,轉移電子的物質的量為15mol | |
| D. | 發令時產生的白煙只是KCl固體顆粒 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 56gFe與足量的鹽酸反應,轉移的電子數為2NA | |
| B. | 標準狀況下,22.4L的水中含有的原子數為3NA | |
| C. | 物質的量濃度為2mol/L的BaCl2溶液中,含有Cl-個數為4NA | |
| D. | 22.4 L CO和CO2的混合氣體中所含的碳原子數一定是NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
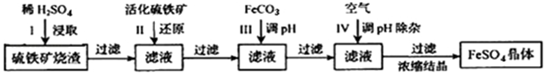
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
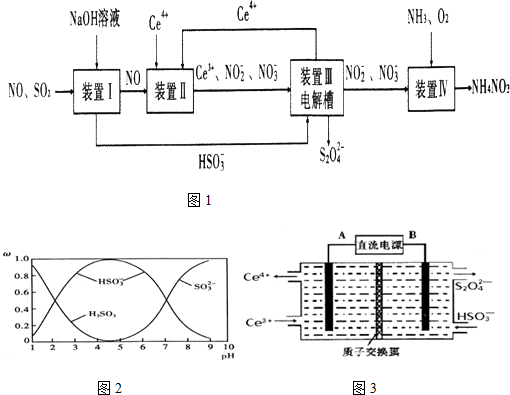
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
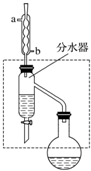 乙酸丁酯是重要的化工原料,具有水果香味.實驗室制備乙酸丁酯的反應、裝置示意圖和有關信息如下:
乙酸丁酯是重要的化工原料,具有水果香味.實驗室制備乙酸丁酯的反應、裝置示意圖和有關信息如下:| 乙酸 | 正丁醇 | 乙酸丁酯 | |
| 熔點/℃ | 16.6 | -89.5 | -73.5 |
| 沸點/℃ | 117.9 | 117 | 126.0 |
| 密度/g•cm-3 | 1.1 | 0.80 | 0.88 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  由如圖知,石墨轉變為金剛石是放熱反應 | |
| B. |  由如圖知,S(g)+O2(g)═SO2(g)△H1,S(s)+O2(g)═SO2(g)△H2則△H1<△H2 | |
| C. |  由如圖知,白磷比紅磷穩定 | |
| D. |  如由圖知,CO(g)+H2O(g)═CO2(g)+H2(g)△H>0 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
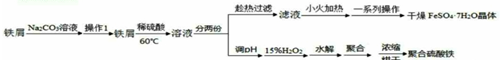
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | CuO是還原劑,被氧化 | |
| B. | H2是還原劑,被氧化 | |
| C. | H2O既不是氧化產物也不是還原產物 | |
| D. | Cu是還原產物,被還原 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com