
【題目】利用圖中所示裝置進行實驗,不能得出相應現象的是( )
選項 | 溶液① | 固體② | 溶液③ | 實驗現象 |
|
A | 濃氨水 | 堿石灰 | 酚酞試液 | 酚酞試液變紅 | |
B | 濃鹽酸 |
|
| 產生淡黃色沉淀 | |
C | 濃硝酸 |
|
| 試管上方產生紅棕色氣體 | |
D | 稀硫酸 |
|
| 產生白色沉淀 |
A.AB.BC.CD.D
【答案】D
【解析】
氨水和堿石灰反應可生成氨氣;濃鹽酸和高錳酸鉀常溫下反應產生氯氣;濃硝酸和銅反應生成NO2,NO2是遇水生成NO,NO與氧氣反應又生成NO2;稀硫酸和碳酸鈉反應可生成二氧化碳氣體,但碳酸酸性弱于鹽酸,不會發生反應。
A.氨水和堿石灰反應可生成氨氣,氨氣顯堿性,使酚酞變紅,故A正確;
B.濃鹽酸和高錳酸鉀常溫下反應產生氯氣,氯氣有強氧化性,置換出硫單質,故B正確;
C.濃硝酸和銅反應生成NO2,NO2是遇水生成NO,NO與氧氣反應又生成NO2,NO2是紅棕色氣體,故C正確;
D.稀硫酸和碳酸鈉反應可生成二氧化碳氣體,但碳酸酸性弱于鹽酸,不會發生反應,無白色沉淀生成,故D錯誤;
答案選D。


科目:高中化學 來源: 題型:
【題目】如圖分別表示生物體內的生物大分子的部分結構模式圖,據圖回答下列問題:

(1)圖甲中的三種物質的基本單位都是___________,其中屬于動物細胞儲能物質的是___________。這三種物質中,在功能上與另外兩種截然不同的是______________________。
(2)圖乙化合物是肺炎雙球菌遺傳物質的一部分,其基本單位是__________,可用圖中字母_______表示,各基本單位之間是通過___________(填①、②或③)連接起來的。
(3)圖丙所示化合物的名稱是___________,是由___________種氨基酸經___________過程形成的,脫去水中的氫元素來自___________,連接氨基酸之間的化學鍵是___________(填化學鍵結構)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外活動小組的同學在實驗室用如下裝置制取乙酸乙酯。其主要步驟如下:
①在30mL的大試管A中按體積比2:3:2的比例配制濃硫酸、乙醇和乙酸的混合溶液。
②按如圖連接好裝置(裝置氣密性良好),用小火均勻地加熱裝有混合溶液的大試管5~10min。
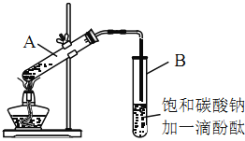
③待試管B收集到一定量產物后停止加熱,撤出試管B并用力振蕩,然后靜置待分層。
④分離出乙酸乙酯層、洗滌、干燥。
已知下列數據:
物質 | 熔點(℃) | 沸點(℃) | 密度(g/cm3) |
乙醇 | -117.0 | 78.0 | 0.79 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
濃硫酸(98%) | ―― | 338.0 | 1.84 |
請回答下列問題:
(1)配制該混合溶液時,加入這三種物質的先后順序是___________;寫出制取乙酸乙酯的化學方程式:___________。
(2)該實驗中,濃硫酸的作用是___________。
(3)上述實驗中飽和碳酸鈉溶液的作用是___________(填字母)。
A 吸收部分乙醇
B 中和乙酸
C 降低乙酸乙酯的溶解度,有利于分層析出
D 加速酯的生成,提高其產率
(4)步驟②中需要小火均勻加熱操作,其主要理由是___________。
(5)步驟③中B試管內的上層物質是___________(填物質名稱)。
(6)步驟④中分離操作用到的主要儀器是___________;可選用的干燥劑為___________(填字母)。
A 生石灰 B NaOH固體
C 堿石灰 D 無水Na2SO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知25℃時,H2SO3 的電離常數Ka1=1.23![]() 10-2,Ka2=5.6
10-2,Ka2=5.6![]() 10-8,HClO的電離常數Ka=2.98
10-8,HClO的電離常數Ka=2.98![]() 10-8,下列說法錯誤的是
10-8,下列說法錯誤的是
A. 常溫下,相同濃度的H2SO3 比HClO酸性強
B. 常溫下,將NaHSO3溶液滴入到NaClO溶液中發生反應:HSO3-+ClO-=SO32-+HClO
C. 常溫下,NaHSO3溶液中HSO3-的電離程度大于其水解程度,NaHSO3溶液呈酸性
D. 將pH=5的HClO溶液加水稀釋到pH=6時,溶液中部分離子濃度會升高
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】
東晉《華陽國志南中志》卷四中已有關于白銅的記載,云南鎳白銅(銅鎳合金)聞名中外,曾主要用于造幣,亦可用于制作仿銀飾品。回答下列問題:
(1)鎳元素基態原子的電子排布式為_________,3d能級上的未成對的電子數為______。
(2)硫酸鎳溶于氨水形成[Ni(NH3)6]SO4藍色溶液。
①SO42中陰離子的立體構型是_____。
②在[Ni(NH3)6]SO4中Ni2+與NH3之間形成的化學鍵稱為______,提供孤電子對的成鍵原子是_____。
③氨的沸點_____(填“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“極性”或“非極性”),中心原子的軌道雜化類型為_______。
(3)單質銅及鎳都是由______鍵形成的晶體:元素銅與鎳的第二電離能分別為:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某鎳白銅合金的立方晶胞結構如圖所示。
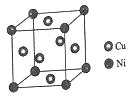
①晶胞中銅原子與鎳原子的數量比為_____。
②若合金的密度為dg/cm3,晶胞參數a=________nm。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】直接碳固體氧化物燃料電池作為全固態的能量轉換裝置,采用固體碳作為燃料,以多孔Pt作電極、氧化鋯為電解質,其工作原理如下圖。下列說法不正確的是

已知:CO2(g)+C=2CO(g) △H=+172.5kJmol-1 CO(g)+![]() O2(g)=CO2(g)△H=-283kJmol-1
O2(g)=CO2(g)△H=-283kJmol-1
A.電極a為正極,電子由b經過導線到a
B.電極b發生的電極反應為:CO+O2--2e-=CO2
C.依據裝置原理可推測,該條件下CO放電比固體C更容易
D.若1molC(s)充分燃燒,理論上放出的熱量為110.5kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】水污染的防治、環境污染的治理是化學工作者研究的重要課題,也是踐行“綠水青山就是金山銀山”的重要舉措。在適當的條件下,將CO2轉化為甲醚:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH ,既可降低CO2造成的溫室效應對環境的影響,還可得到重要的有機產物。
CH3OCH3(g)+3H2O(g) ΔH ,既可降低CO2造成的溫室效應對環境的影響,還可得到重要的有機產物。
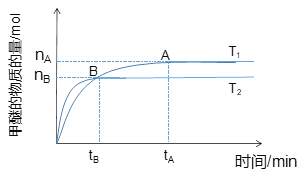
(1)在容積為2 L密閉容器中合成甲醇;其他條件不變的情況下,考察溫度對反應的影響,如圖所示
①該反應的ΔH________0;ΔS______0(填“>”、“<”或“=”)。
②下列措施可增加甲醚產率的是_____________。
A.升高溫度 B.將CH3OCH3(g)從體系中分離
C.使用合適的催化劑 D.充入He,使體系總壓強增大
③溫度為T1時,從反應開始到平衡,生成甲醚的平均速率為___________________。
(2)一定條件下,向某恒容密閉容器中充入x mol CO2和y mol H2合成甲醚
①下圖1中能表示該反應的平衡常數K與溫度T之間的變化關系曲線為______(填“a”或“b”)。
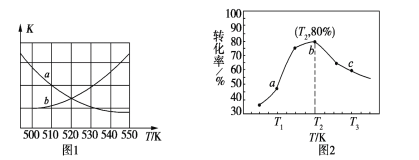
②若x=2、y=3,測得在相同時間內不同溫度下H2的轉化率如圖2所示,則在該時間段內,恰好達到化學平衡時,容器內的壓強與反應開始時的壓強之比為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以A為原料,經過以下途徑可以合成一種重要的制藥原料有機物F。
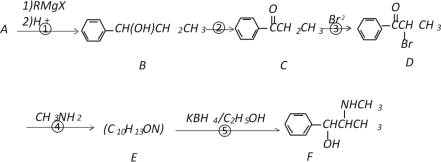
已知:
I.
II.A蒸氣的密度是相同條件下氫氣密度的53倍。
請回答下列問題:
(1)寫出A的結構簡式_____________;E中含氧官能團的名稱為__________________。
(2)D→E的反應類型是_____________,E→F的反應類型是_________________。
(3)寫出反應④的化學反應方程式___________________________________________。
(4)符合下列條件的C的同分異構體有________種(不考慮順反異構)。
a.苯環上有兩個取代基 b.能與NaOH溶液反應 c.分子中含有兩種官能團
(5)C的所有同分異構體在下列一種表征儀器中顯示的信號(或數據)完全相同的是(_______)(填字母序號)
A.核磁共振儀 B.元素分析儀 C.質譜儀 D.紅外光譜儀
(6)以A為原料可以合成高分子化合物G(  ),請設計出合理的合成路線(無機試劑任選)。________________________________________________________________
),請設計出合理的合成路線(無機試劑任選)。________________________________________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物HIn在水溶液中因存在以下電離平衡HIn(aq,紅色) ![]() H+(aq)+ In-(aq,黃色)故可作酸堿指示劑。濃度為0.02mol/L的下列溶液:① 鹽酸 ② 石灰水 ③ NaCl溶液 ④ NaHSO4溶液 ⑤ NaHCO3溶液 ⑥ 氨水,其中能使指示劑顯紅色的是
H+(aq)+ In-(aq,黃色)故可作酸堿指示劑。濃度為0.02mol/L的下列溶液:① 鹽酸 ② 石灰水 ③ NaCl溶液 ④ NaHSO4溶液 ⑤ NaHCO3溶液 ⑥ 氨水,其中能使指示劑顯紅色的是
A. ④⑤B. ③⑤C. ①④D. ②⑥
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com