
| A. | 25℃時,0.1mol•L-1HF溶液中pH=1 | |
| B. | Ksp(CaF2)隨溫度和濃度的變化而變化 | |
| C. | 該體系中沒有沉淀產生 | |
| D. | 該體系中有CaF2產生沉淀 |
分析 A.HF酸為弱酸,溶液中不能完全電離;
B.Ksp只與溫度有關;
C.根據濃度商Qc與Ksp的大小店鋪;
D.根據該體系中的濃度商與溶度積的大小進行判斷.
解答 解:A.HF酸為弱酸,不能完全電離,則25℃時,0.1 mol•L-1HF溶液中pH>1,故A錯誤;
B.Ksp只與溫度有關,則Ksp(CaF2)隨溫度的變化而變化,與濃度無關,故B錯誤;
C.兩溶液混合后,c(Ca2+)=0.1 mol•L-1,c(F-)=$\sqrt{{K}_{a}×c(HF)}$=6×10-3ol/L,則Qc=c2(F-)•c(Ca2+)=(3.6×10-5mol/L)•0.1 mol•L-1=3.6×10-6>Ksp,說明有沉淀產生,故C錯誤;
D.根據C的計算可知,該體系中有沉淀生成,故D正確;
故選D.
點評 本題考查難溶物溶解平衡及溶度積的計算,題目難度中等,注意利用溶度積判斷沉淀能否生成,把握影響平衡常數的因素即可解答.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 為測定某NaOH溶液的濃度,通常用已潤洗的酸式滴定管放出25.00mL標準鹽酸溶液于錐形瓶中,加2滴酚酞,然后向已潤洗的堿式滴定管中注入未知濃度的NaOH溶液進行滴定 | |
| B. | 用無水CuSO4 、BaCl2溶液、稀鹽酸、NaOH溶液、紅色石蕊試紙、KSCN溶液、新制氯水等試劑可確定摩爾鹽的化學式 | |
| C. | 通常采用產生氣泡的快慢,來比較不同條件下Na2S2O3溶液與稀硫酸的反應速率 | |
| D. | 萃取操作所用的分液漏斗使用前應加入少量水,見旋塞芯處是否漏水,待確認不漏水后則可以使用 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分子式為C10H1202的有機物,①苯環上有兩個取代基,②能與NaHCO3反應生成氣體,滿足以上2個條件的該有機物的同分異構體有15種 | |
| B. | 分子式為C4H8Cl2機物,只含有一個甲基的同分異構體有7種 | |
| C. | 分子式為C4H10O的醇,能在銅催化下被O2氧化為醛的同分異構體有4種 | |
| D. |  分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
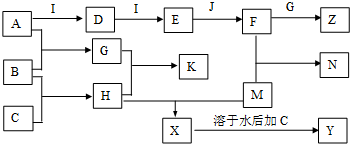
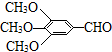 )和抗癲癇藥物H(
)和抗癲癇藥物H(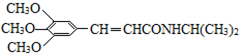 )的路線如下(部分反應略去條件和試劑):
)的路線如下(部分反應略去條件和試劑):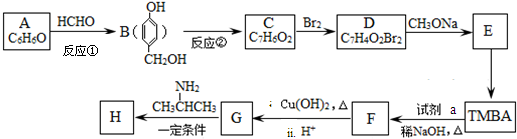
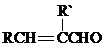 +H2O
+H2O +2Br2→
+2Br2→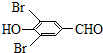 +2HBr;
+2HBr;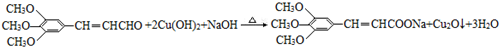 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 銅片消耗完所需時間 | |
| B. | 反應中氧化劑得到電子總數 | |
| C. | 反應后溶液中銅離子濃度(反應后溶液體積不變) | |
| D. | 反應生成氣體的體積(同溫、同壓) |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 20 | B. | 21 | C. | 22 | D. | 23 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題

| A. | 氣態氫化物的還原性:X>Y、M>R | B. | 原子半徑:Z>M>R、M<X<Y | ||
| C. | M與Z的原子核外電子數相差16 | D. | Q的最高價氧化物一定能溶于強堿 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com