
 以黃銅礦精礦為原料,制取硫酸銅及金屬銅的工藝如下所示:
以黃銅礦精礦為原料,制取硫酸銅及金屬銅的工藝如下所示:
| ||
| 3.2g |
| 64g/mol |
| ||
| 3.2g |
| 64g/mol |


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
| ||
| ||
查看答案和解析>>
科目:高中化學 來源:高一化學(通用各科奧林匹克ABC卷及解析) 題型:043
用黃銅礦煉銅按反應物和生成物可將總反應寫成:
事實上冶煉反應是分步進行的.①黃銅礦在氧氣作用下生成硫化亞銅和硫化亞鐵;②硫化亞鐵在氧氣作用下生成氧化亞鐵,并與二氧化硅反應生成礦渣;③硫化亞銅與氧氣反應生成氧化亞銅;④硫化亞銅與氧化亞銅反應生成銅.
(1)寫出上述各個分步反應的化學方程式
①________________________________________________________;
②________________________________________________________;
③________________________________________________________;
④________________________________________________________.
(2)總反應的化學方程式中各物質的系數依次為_____________.
(3)據最新報道,有一種叫Thibacillus ferroxidans的細菌在氧氣存在下可以將黃銅礦氧化成硫酸鹽.反應是在酸性溶液中發生的.試寫出配平的化學方程式:________________.
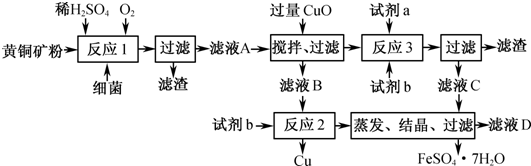
(4)最近我國學者發現,以精![]() 礦為原料在沸騰爐中和
礦為原料在沸騰爐中和![]() (空氣)反應,生成物冷卻后經溶解、除鐵、結晶,得到
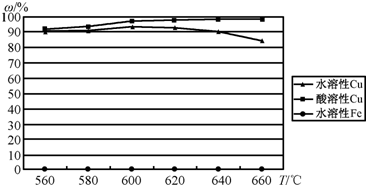
(空氣)反應,生成物冷卻后經溶解、除鐵、結晶,得到![]() ,成本降低了許多.實驗結果如下:
,成本降低了許多.實驗結果如下:

回答如下問題:
①![]() 和
和![]() 主要反應的化學方程式為:________________;
主要反應的化學方程式為:________________;
②實際生產過程的沸騰爐溫度為600℃~620℃.控制反應溫度的方法是:________.
③溫度高于600℃~620℃生成物中水溶性Cu(%)下降的原因是:________.
查看答案和解析>>
科目:高中化學 來源:2012-2013學年北京市豐臺區高三上學期期末考試化學試卷(解析版) 題型:填空題
以黃銅礦精礦為原料,制取硫酸銅及金屬銅的工藝如下所示:
Ⅰ.將黃銅礦精礦(主要成分為CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下裝置進行電化學浸出實驗

將精選黃銅礦粉加入電解槽陽極區,恒速攪拌,使礦粉溶解。在陰極區通入氧氣,并加入少量催化劑。
Ⅲ.一段時間后,抽取陰極區溶液,向其中加入有機萃取劑(RH)發生反應:
2RH(有機相)+ Cu2+(水相) R2Cu(有機相)+ 2H+(水相)
R2Cu(有機相)+ 2H+(水相)
分離出有機相,向其中加入一定濃度的硫酸,使Cu2+得以再生。
Ⅳ.電解硫酸銅溶液制得金屬銅。
(1)黃銅礦粉加入陽極區與硫酸及硫酸鐵主要發生以下反應:
CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S 2Fe3+ + H2S = 2Fe2+ + S↓+ 2H+
① 陽極區硫酸鐵的主要作用是 。
② 電解過程中,陽極區Fe3+的濃度基本保持不變,原因是 。
(2)陰極區,電極上開始時有大量氣泡產生,后有固體析出,一段時間后固體溶解。寫出上述現象對應的反應式 。
(3)若在實驗室進行步驟Ⅲ,分離有機相和水相的主要實驗儀器是 ;加入有機萃取劑的目的是 。
(4)步驟Ⅲ,向有機相中加入一定濃度的硫酸,Cu2+得以再生的原理是 。
(5)步驟Ⅳ,若電解200mL0.5 mol/L的CuSO4溶液,生成銅3.2 g,此時溶液中離子濃度由大到小的順序是 。
查看答案和解析>>
科目:高中化學 來源:江蘇模擬題 題型:填空題


查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com