
【題目】明礬[KAI(SO4)212H2O]是一種重要的化工產品,在生產、生活中都有廣泛的用途。
某工廠計劃利用煉鋁廠的廢料鋁灰(含Al、A12O3、少量SiO2和FeOxFe2O3)為原料生產明礬產品,設計的生產工藝流程如下:
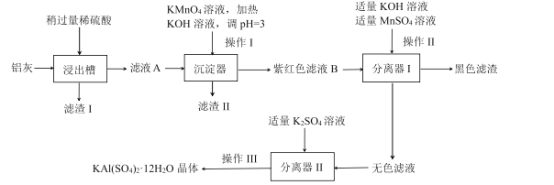
己知:![]()
請回答下列問題:
(1)檢驗濾液A中是否存在Fe2+,可用K3[Fe(CN)6]溶液,請寫出其檢驗的離子反應方程式____。
(2)沉淀器中加入KMnO4溶液的作用是____;有人認為該生產流程較為復雜,可以用____溶液(填化學式)代替KMnO4溶液而使操作Ⅰ和操作Ⅱ過程得到優化。
(3)操作Ⅲ是 ___、____(填操作名稱)、過濾、洗滌;在洗滌晶體時采用的洗滌劑最合適的是 ___(填正確答案標號)。
A.稀硫酸 B.蒸餾水 C.70%酒精
(4)明礬可作凈水劑,其凈水原理是 ____用離子方程式表示)。
(5)在沉淀器中調pH=3,請計算說明Fe3+是否完全沉淀(當Fe3+離子濃度小于或等于1.0x 10-5 mol/L時,可以認為溶液中無該離子)____。
【答案】2Fe(CN)63- +3Fe2+= Fe3[Fe(CN)6]2↓ 氧化Fe2+為Fe3+ H2O2 蒸發濃縮 冷卻結晶 C Al3++3H2O![]() Al(OH)3(膠體)+3H+ 由
Al(OH)3(膠體)+3H+ 由![]() 可知,
可知,![]() ,所以Fe3+沒有沉淀完全。
,所以Fe3+沒有沉淀完全。
【解析】
鋁灰含Al、A12O3、少量SiO2和FeOxFe2O3,加稀硫酸,得到濾渣∣為SiO2,濾液中含有Al3+、Fe2+、Fe3+,加入KMnO4溶液,氧化
Fe2+為Fe3+,加KOH溶液調節pH,將Fe3+反應生成Fe(OH)3的紅褐色沉淀除去,所以濾渣Ⅱ為Fe(OH)3沉淀,紫紅色溶液B中含MnO4-,加入MnSO4,發生歧化反應,生成MnO2的黑色固體,得到無色溶液中主要含有Al3+,加入K2SO4,生成明礬[KAI(SO4)212H2O]晶體。
(1)Fe2+與K3[Fe(CN)6]溶液反應生成Fe3[Fe(CN)6]2的藍色沉淀,其離子反應方程式為:2Fe(CN)63- +3Fe2+= Fe3[Fe(CN)6]2↓,故答案為:2Fe(CN)63- +3Fe2+= Fe3[Fe(CN)6]2↓。
(2)KMnO4溶液具有強氧化性,氧化Fe2+為Fe3+,過氧化氫也具有強氧化性,也能將Fe2+氧化為Fe3+,可以用H2O2溶液代替KMnO4溶液,故答案為:氧化Fe2+為Fe3+;H2O2。
(3)得到明礬[KAI(SO4)212H2O]晶體,蒸發濃縮、冷卻結晶、過濾、洗滌;[KAI(SO4)212H2O]易溶于水,也與稀硫酸反應,所以用70%的酒精洗滌晶體,故答案為:蒸發濃縮;冷卻結晶;C。
明礬可作凈水劑,[KAI(SO4)212H2O]中Al3+水解生成氫氧化鋁的膠體,吸附水中懸浮的顆粒,其離子反應方程式為:Al3++3H2O![]()
Al(OH)3(膠體)+3H+,故答案為:Al3++3H2O![]() Al(OH)3(膠體)+3H+;
Al(OH)3(膠體)+3H+;
(5)pH=3,![]() ,由
,由![]() 可知,
可知,![]() ,所以Fe3+沒有沉淀完全,故答案為:由
,所以Fe3+沒有沉淀完全,故答案為:由![]() 可知,
可知,![]() ,所以Fe3+沒有沉淀完全。
,所以Fe3+沒有沉淀完全。


科目:高中化學 來源: 題型:
【題目】氧化鋁陶瓷常用于厚膜集成電路,制備氧化鋁陶瓷的合成路線如圖所示,回答下列問題。
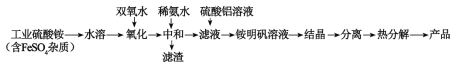
(1)“氧化”步驟發生的離子方程式為:___,使用雙氧水作氧化劑優點為___:
(2)“熱分解”得到的產物除了氧化鋁外,還有NH3、N2、SO2、SO3、H2O生成,則氧化產物和還原產物的物質的量之比為___。
(3)銨明礬晶體的化學式為NH4Al(SO4)2·12H2O,“熱分解”步驟中,其各溫度段內受熱“失重計算值”(失重計算值%=![]() ×100%)如表所示:
×100%)如表所示:
溫度區間(℃) | 18→190 | 190→430 | 430→505 | 505→900 |
失重計算值(%) | 39.20 | 7.80 | 13.00 | 26.00 |
通過上述數據經粗略計算可判斷,在溫度區間___銨明礬基本上失去了全部結晶水。
(4)“結晶”步驟中常采用的操作是___。
(5)合成過程中常使用過量的工業硫酸銨,可利用硫酸銨溶液水解顯酸性抑制硫酸鋁水解,另外的一個重要作用是___。
(6)通常認為金屬離子濃度等于1×10-5mol/L即可認為沉淀完全,試計算常溫下“中和”步驟中需要調節溶液pH=___(保留一位小數,已知:Ksp[Fe(OH)3]=8.0×10-38,lg5=0.7)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鄰甲基苯甲酸主要用于農藥、醫藥及有機化工原料的合成,其結構簡式為 ,下列關于該物質的說法正確的是( )。
,下列關于該物質的說法正確的是( )。
A.該物質能與溴水生成白色沉淀
B.該物質含苯環的同分異構體中能水解且含有甲基的共5種
C.1mol該物質最多能與4molH2生加成反應
D.該物質中所有原子共平面
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】白銅是一種銅鎳合金,為我國首先發明使用并傳入世界各地,其發明在世界化學史和冶金史中都占有重要地位。白銅廣泛用于造船、石油、化工、建筑、電力、精密儀表、醫療器械、樂器制作等部門作耐蝕的結構件。
(1)鎳元素基態原子的電子排布式為______________,3d能級上的未成對電子數為______。
(2)單質銅、鎳都是通過__________ 鍵形成晶體;比較元素銅與鎳的第二電離能大小,I2(Cu)_____I2(Ni) (填“>”或“<”),原因是______________________。
(3)金屬鎳粉在CO氣流中輕微加熱,生成無色(或黃色)易揮發的液體Ni(CO)4。 寫出一種與Ni(CO)4的配體互為等電子體的物質的分子式_____ ;推測Ni(CO)4的晶體類型是_______。呈正四面體構型的Ni( CO)4。易溶于下列物質中的______(填字母)。
A.水 B.四氯化碳 C.苯 D.硫酸鎳溶液
(4)N和Cu元素形成的化合物的晶胞結構如圖所示,則該化合物的化學式為______該化合物的摩爾質量為M g●mol-1, NA代表阿伏加德羅常數的值。若該晶胞的邊長為a pm,則該晶體的密度是_____g .cm-3。
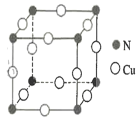
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)下列是中學化學中熟悉的物質:
O2 金剛石 NaBr H2SO4 Na2CO3 Na2S NaHSO4
回答下列問題:
這些物質中,只含共價鍵的是________;只含離子鍵的是________;既含離子鍵又含共價鍵的是________。
(2)寫出下列物質的電子式。
Na2O2:_________________;
NH4H:_______________________;
(3)寫出下列物質的結構式。
CO2:____________________
H2O2:_______________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的值。下列說法正確的是
A. 常溫常壓下,11.2 LHCl氣體中含有的分子數為0.5NA
B. 常溫常壓下,5.6 g N2和CO混合物中所含有的原子數為0.4NA
C. 將0.2 mol FeCl3水解制成膠體,所得膠體粒子數為0.2NA
D. 50 mL12 mol/L鹽酸與足量MnO2共熱,轉移電子數為0.3NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)氯酸是一種強酸,氯酸的濃度超過40%就會迅速分解,反應的化學方程式為8HClO3=3O2↑+2Cl2↑+4HClO4+2H2O。根據題意完成下列小題:
①在上述變化過程中,發生還原反應的過程是_____→____(填化學式)。
②該反應的氧化產物是________(填化學式)。
(2)已知測定錳的一種方法是:錳離子轉化為高錳酸根離子,反應體系中有H+、Mn2+、H2O、IO3-、MnO4-、IO4-。有關反應的離子方程式為_____。
(3)工業尾氣中含有大量的氮氧化物,NH3催化還原氮氧化物(SCR)技術是目前應用最廣泛的煙氣氮氧化物脫除技術。反應原理如圖所示:
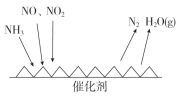
①由上圖可知SCR技術中的氧化劑為_____________。
②用Fe作催化劑加熱時,在氨氣足量的情況下,當NO2與NO的物質的量之比為1∶1時,寫出該反應的化學方程式:________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯化鋁可制備無機高分子混凝劑,在有機合成中有廣泛的用途。完成下列填空:
(1) 實驗室配制氯化鋁溶液時加入鹽酸的目的是____________。
(2)往AlCl3溶液中加入過量下列溶液,最終得到無色澄清溶液的是______(填編號)。
a Na2CO3 b NaOH c NaAlO2 d H2SO4
取AlCl3溶液,用小火持續加熱至水剛好蒸干,生成白色固體的組成可表示為:Al2(OH)nCl(6-n),為確定n的值,取3.490g白色固體,全部溶解在0.1120 mol的HNO3(足量)中,并加水稀釋成100 mL,將溶液分成兩等價,進行如下實驗:
(3)一份與足量氨水充分反應后過濾、洗滌、灼燒,最后得Al2O3的質量為1.020g。判斷加入氨水已足量的操作是________。過濾、洗滌后至少要灼燒_______次(填寫數字);測定樣品中鋁元素含量時不選擇測定干燥Al(OH)3的質量,而是測定A12O3的質量的原因可能是____(選填編號)。
a 干燥Al(OH)3固體時易失水 b Al2O3的質量比Al(OH)3大,誤差小
c 沉淀Al(OH)3時不完全 d 灼燒氧化鋁時不分解
(4)從另一份溶液中取出20.00 mL,用0.1290 mol/L的標準NaOH溶液滴定過量的硝酸,滴定前滴定管讀數為0.00 mL,終點時滴定管液面(局部)如圖所示(背景為白底藍線的滴定管)。則滴定管的讀數__________mL,Al2(OH)nCl(6-n)中n的值為__________。
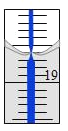
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化合物6.4 g在氧氣中完全燃燒,只生成8.8 g CO2和7.2 g H2O。下列說法中正確的是( )
①該化合物僅含碳、氫兩種元素 ②該化合物中碳、氫原子個數比為1∶4
③無法確定該化合物是否含有氧元素 ④該化合物中一定含有氧元素
A. ①②B. ②④C. ③④D. ②③
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com