
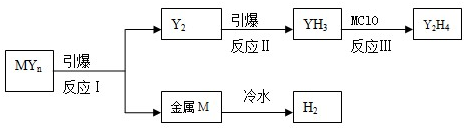
n(YH3)(mol) 溫度 | 3min | 4min | 5min | 6min |
| T1 | 0.8 | 1.0 | 1.2 | 1.2 |
| T2 | 0.7 | 0.8 | 1.0 | 1.0 |
| 1 |
| 2 |
| c(H2) |
| c(YH3) |
| ||
| 5min |
| 3.5mol-1.5mol |
| 2L |
| 2mol-0.5mol |
| 2L |
| 0.52 |
| 0.75×13 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| c(H2) |
| c(YH3) |


科目:高中化學 來源: 題型:
| A、在標準狀況下,1摩爾任何物質的體積都約為22.4升 |
| B、22.4升氧氣所含的氧原子數為2 NA個 |
| C、在標準狀況下,1摩爾水的體積約為22.4升 |
| D、1摩爾某氣體的體積約為22.4升時,該氣體不一定處于標準狀況下 |
查看答案和解析>>
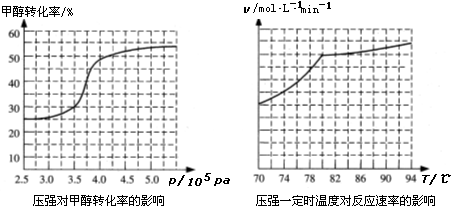
科目:高中化學 來源: 題型:
| 化學健 | C≡O | H-H | C-H | H-O |
| 鍵能(kJ/mol) | a | b | c | d |
查看答案和解析>>
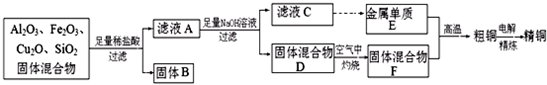
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
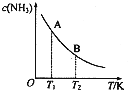 氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產、生活中有著重要作用.請回答下列問題:
氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產、生活中有著重要作用.請回答下列問題: | c(N2) | c(H2) | c(H2) |
| 0 | 0.6 | 1.8 | 0 |
| 3 | 0.52 | x | 0.16 |
| 6 | 0.36 | 1.08 | 0.48 |
| 9 | 0.36 | 1.08 | 0.48 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com