
【題目】Ⅰ.下表為元素周期表的一部分,請按要求回答問題:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中元素______的非金屬性最強,元素_____的金屬性最強(填元素符號)。
(2)表中元素④、⑨形成的氫化物的穩定性順序為_____>______(填化學式)。
(3)表中元素③、④、⑥、⑦的原子半徑大小為____>____>___>___(填元素符號)。
Ⅱ.A、B、W、D、E為短周期元素,且原子序數依次增大,五種元素核內質子數之和為39,B、W同周期,A、D同主族,A、W能形成兩種液態化合物A2W和A2W2,E元素的周期序數與主族序數相等。
(1)A2W的電子式為________。(2) E元素在周期表中的位置為_______ 。
(3)W、D、E三種元素的簡單離子半徑由小到大的順序為_______(填離子符號)。
(4)在一定條件下,D元素的單質能與A元素的單質化合生成DA,DA能與水反應放氫氣,則其化學方程式為_______
(5)若要比較D和E的金屬性強弱,下列實驗方法可行的是_______。
a.將D單質置于E的鹽溶液中,若單質D不能置換出單質E,說明D的金屬性弱
b.將少量D、E的單質分別投入到水中,若D反應而E不反應,說明D的金屬性強
C.比較相同條件下D和E的最高價氧化物對應水化物的溶解性若前者比后者溶解度大,說明D的金屬性強
【答案】 F Na HF HCl Na Mg O F ![]() 第3周期第ⅢA族 Al3+ < Na+ < O2- NaH+H2O=NaOH+H2↑ b
第3周期第ⅢA族 Al3+ < Na+ < O2- NaH+H2O=NaOH+H2↑ b
【解析】本題考查的是元素周期表和元素周期律的內容,難度不大,掌握元素金屬性和非金屬性的變化規律是關鍵。
Ⅰ.結合元素周期表分析,①為鋰,②為碳,③為氧,④為氟,⑤為氖,⑥為鈉,⑦為鎂,⑧為硫,⑨為氯。(1)根據元素周期律分析,在周期表中最右上角的元素的非金屬性最強,在周期表中最左下角的元素金屬性最強,所以氟非金屬性最強,鈉金屬性最強;(2)氟的非金屬性比氯強,所以形成的氫化物的穩定性中氟化氫比氯化氫強;(3)根據電子層數越多,半徑越大,相同電子層數的原子,最外層電子數越多半徑越小分析,原子半徑由大到小的順序為: Na> Mg> O>F;Ⅱ. A、B、W、D、E為短周期元素,且原子序數依次增大, A、W能形成兩種液態化合物A2W和A2W2,則A為氫元素,W為氧元素,形成水和雙氧水。因為A、D同主族,所以D為鈉元素。E為第三周期,所以根據元素的周期序數與主族序數相等,該元素為鋁元素。結合五種元素核內質子數之和為39,B、W同周期,則B為6號元素碳。 (1) A2W為水,電子式為![]() ; (2)鋁元素在第3周期第ⅢA族;(3)氧離子和鈉離子和鋁離子電子層結構相同,根據核電荷數越大,半徑越小分析,半徑順序為Al3+ < Na+ < O2-; (4)氫和鈉化合生成氫化鈉,和水反應生成氫氣,方程式為:NaH+H2O=NaOH+H2↑;(5)比較鈉和鋁的金屬性的強弱,可以將鈉和鋁分別投入水中,鈉和水反應而鋁和水不反應,不能將鈉投入鋁的鹽溶液中,因為鈉先與水反應,不能比較金屬性強弱,可以比較最高價氧化物對應水化物的堿性強弱,不能比較其溶解性強弱,故選b。
; (2)鋁元素在第3周期第ⅢA族;(3)氧離子和鈉離子和鋁離子電子層結構相同,根據核電荷數越大,半徑越小分析,半徑順序為Al3+ < Na+ < O2-; (4)氫和鈉化合生成氫化鈉,和水反應生成氫氣,方程式為:NaH+H2O=NaOH+H2↑;(5)比較鈉和鋁的金屬性的強弱,可以將鈉和鋁分別投入水中,鈉和水反應而鋁和水不反應,不能將鈉投入鋁的鹽溶液中,因為鈉先與水反應,不能比較金屬性強弱,可以比較最高價氧化物對應水化物的堿性強弱,不能比較其溶解性強弱,故選b。


科目:高中化學 來源: 題型:
【題目】分枝酸可用于生化研究。其結構簡式如圖。下列關于分枝酸的敘述正確的是

A. 分子中存在兩種含氧官能團
B. 1mol該有機物可以分別與3molBr2和5molH2發生加成反應
C. 該有機物可以使溴水和酸性高錳酸鉀溶液均褪色
D. 該有機物可以發生氧化反應、加成反應、取代反應和水解反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】相似相溶(經驗規律):一般來說,由極性分子組成的溶質易溶于極性分子組成的溶劑,非極性分子組成的溶質易溶于非極性分子組成的溶劑。以下可以用相似相溶規律說明的是( )
A. Cl2可溶于水 B. I2可溶于水
C. HCl易溶于水 D. NH3易溶于苯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應中符合下列圖象的是( ) 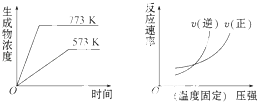
A.N2(g)+3H2(g)2NH5(g)△H=﹣Q1kJmol﹣1(Q1>0)
B.2SO5(g)2SO2(g)+O2(g)△H=+Q2kJmol﹣1(Q2>0)
C.4NH5(g)+5O2(g)4NO(g)+6H2O(g)△H=﹣Q3kJmol﹣1(Q3>0)
D.H2(g)+CO(g)C(g)+H2O(g)△H=+Q4kJmol﹣1(Q4>0)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】四種常見有機物分子的比例模型示意圖如下,其中甲、乙、丙為烴,丁為烴的衍生物。
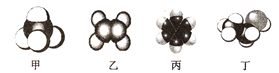
(1)可以鑒別甲和乙的試劑為__________;
a.稀硫酸 b.溴的四氯化碳溶液 c.水 d.酸性高錳酸鉀溶液
(2)上述物質中有毒、有特殊氣味,且不溶于水、密度比水小的是______(填名稱),將其加入溴水中,振蕩后靜置,觀察到的現象是______。
(3)以乙為主要原料合成乙酸,合成路線如圖所示:(已知2CH3CHO+O2![]() 2CH3COOH)
2CH3COOH)
![]()
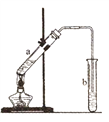
①丁生成A的化學方程式為_______________;
②如圖,丁與乙酸在濃硫酸作用下發生反應,當觀察到b試管中有明顯現象時,停止實驗。生成的有機物的結構簡式為___________;試管b中的溶液是___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是( )
A.95℃純水的pH<7,說明加熱可導致水呈酸性
B.pH=3的醋酸溶液稀釋至10倍后pH=4
C.0.2 mol/L的鹽酸與0.1 mol/L的鹽酸等體積水混合后pH=1.5
D.pH=3的醋酸溶液與pH=11的氫氧化鈉溶液等體積混合后pH<7
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】酸、堿、鹽均屬于電解質,它們的水溶液中存在各種平衡.
(1)氨水是中學常見的堿溶液 ①下列事實可證明NH3H2O是弱堿的是(填字母序號).
A.常溫下,0.1molL﹣1氨水pH為11
B.氨水能跟氯化亞鐵溶液反應生成氫氧化亞鐵
C.常溫下,0.1molL﹣1氯化銨溶液的pH為5
D. 銨鹽受熱易分解
②下列方法中,可以使氨水電離程度增大的是(填字母序號).
A.加入少量氯化鐵固體 B.通入氨氣
C.加入少量氯化銨固體 D.加水稀釋
(2)鹽酸和醋酸是中學常見酸 用0.1molL﹣1NaOH溶液分別滴定體積均為20.00mL、濃度均為0.1molL﹣1的鹽酸和醋酸溶液,得到滴定過程中溶液pH隨加入NaOH溶液體積而變化的兩條滴定曲線.
①滴定醋酸的曲線是(填“I”或“II”).
②滴定開始前,三種溶液中由水電離出的c(H+)最大的是 .
③V1和V2的關系:V1V2(填“>”、“=”或“<”).
④M點對應的溶液中,各離子的物質的量濃度由大到小的順序是 .
(3)常溫下將0.2mol/L HCl溶液與0.2mol/L氨水溶液等體積混合(忽略混合后溶液體積的變化),測得混合溶液的pH=6,求混合溶液中下列算式的精確計算結果(填具體數字): c(H+)﹣c(NH3﹒H2O)=mol/L.
(4)銨鹽和氯化銀是中學常見鹽 ①0.1molL﹣1的(NH4)2Fe(SO4)2溶液,與同濃度的(NH4)2SO4溶液相比較(填溶質的化學式)溶液中NH4+的濃度更大,其原因是
②含有足量AgCl固體的飽和溶液,AgCl在溶液中存在如下平衡:
AgCl(s)Ag+(aq)+Cl﹣(aq)
在25℃時,AgCl的Ksp=1.8×10﹣10 . 現將足量AgCl分別放入下列液體中:
①100mL蒸餾水
②100mL 0.3molL﹣1AgNO3溶液
③100mL 0.1molL﹣1 MgCl2溶液
充分攪拌后冷卻到相同溫度,Ag+濃度由大到小的順序為(填序號).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】醋酸乙烯(CH3COOCH=CH2)是一種重要的有機化工原料,以二甲醚(CH3OCH3)與合成氣(CO、H2)為原料,醋酸鋰、碘甲烷等為催化劑,在高壓反應釜中一步合成醋酸乙烯及醋酸。
回答下列問題:
(1)常溫下,將濃度均為a mol/L的醋酸鋰溶液和醋酸溶液等體積混合,測得混合液的pH=b,則混合液中c(CH3COO-)=______mol/L( 列出計算式即可)。
(2)合成二甲醚:
Ⅰ.2H2(g)+CO(g)=CH3OH(g) ΔH1=-91.8kJ/mol;
Ⅱ.2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ/mol;
Ⅲ.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.3 kJ/mol.
已知:H-H 的鍵能為436kJ/mol,C=O的鍵能為803kJ/mol,H-O的鍵能為464kJ/mol,則C≡O的鍵能為_____kJ/mol.
(3)二甲醚(DME)與合成氣一步法合成醋酸乙烯(VAC)的反應方程式為2CH3OCH3(g)+4CO(g)+H2(g) ![]() CH3COOCH=CH2(g)+2CH3COOH(g),T℃時,向2L恒容密閉反應釜中加入0.2 molCH3OCH3、0.4 molCO、0.1molH2發生上述反應,10min達到化學平衡,測得VAC的物質的量分數為10%。
CH3COOCH=CH2(g)+2CH3COOH(g),T℃時,向2L恒容密閉反應釜中加入0.2 molCH3OCH3、0.4 molCO、0.1molH2發生上述反應,10min達到化學平衡,測得VAC的物質的量分數為10%。
①0~10min內,用CO濃度變化表示的平均反應速率v(CO)=______;該溫度下,該反應的平衡常數K=__________。
②下列能說明該反應達到平衡狀態的是______(填選項字母)。
A.V正(DME)=v逆(H2)≠0
B.混合氣體的密度不再變化
C.混合氣體的平均相對分子質量不再變化
D.c(CO):c(VAC)=4:1
③如圖是反應溫度對二甲醚(DME)的轉化率和醋酸乙烯(VAC)選擇性(醋酸乙烯的選擇性Svac=![]() )的影響,該反應的ΔH______0(填“>”“<”或“=”);控制的最佳溫度是___________.
)的影響,該反應的ΔH______0(填“>”“<”或“=”);控制的最佳溫度是___________.

④保持溫度不變,向反應釜中通入氬氣增大壓強,則化學平衡______(填“向正反應方向”“向逆反應方向"或“不”)移動。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅、磷及其化合物是非常重要的物質。
(1)Cu+的電子排布式____;
(2)在硫酸銅溶液中加入過量KCN,生成配合物[Cu(CN)4]2-。[Cu(CN)4]2-的配體為____,[Cu(CN)4]2-中C的雜化方式為____,則1個[Cu(CN)4]2-中含有的σ鍵的數目為____個;
(3)鋰—磷酸氧銅電池正極的活性物質是Cu4O(PO4)2,不溶于水,可通過Na3PO4、CuSO4和NH3·H2O反應制取。制取Cu4O(PO4)2的化學方程式為____;
(4)PCl5中P-Cl鍵長有198pm和206pm兩種。PCl5是非極性分子,可作為導電熔體,其原理為PCl5電離為一個陰離子和一個陽離子,其中陰離子為正八面體,陽離子為正四面體,寫出一種陽離子的等電子體的化學式____,PCl5的立體構型為____;
(5)金屬銅屬于面心立方晶體,銅的密度為ag·cm3,NA表示阿伏伽德羅常數,則銅的配位數____,銅的金屬半徑為___pm。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com