
亞氯酸鈉(NaClO2)是一種強氧化性漂白劑,廣泛用于紡織、印染和食品工業。它在堿性環境中穩定存在。某同學查閱資料后設計生產NaClO2的主要流程如下。

(1)Ⅰ、Ⅲ中發生反應的還原劑分別是 、 (填化學式)。
(2)Ⅱ中反應的離子方程式是 。
(3)A的化學式是 ,裝置Ⅲ中A在 極區產生。
(4)ClO2是一種高效水處理劑,可用亞氯酸鈉和稀鹽酸為原料制備:
5NaClO2 + 4HCl = 5NaCl + 4ClO2↑ + 2H2O。
① 該反應中氧化劑和還原劑的物質的量之比是 。
② 研究表明:若反應開始時鹽酸濃度越大,則氣體產物中Cl2的含量越大,運用氧化還原反應規律分析其原因是 。
(5)NaClO2變質可分解為NaClO3和NaCl。取等質量變質前后的NaClO2試樣配成溶液,分別與足量FeSO4溶液反應時,消耗Fe2+的物質的量相同,從電子守恒的角度解釋其原因是 。
(1)Na2SO3 H2O(2分)
(2)2ClO2 + H2O2 + 2OH- = 2ClO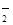 + O2↑+ 2H2O(2分)
+ O2↑+ 2H2O(2分)
(3)H2SO4 (2分) 陽 (2分)
(4)1∶4 (2分) ClO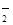 的氧化性或Cl-的還原性隨溶液的酸性和濃度的增大而增強,因此Cl-被氧化得到Cl2 (2分)
的氧化性或Cl-的還原性隨溶液的酸性和濃度的增大而增強,因此Cl-被氧化得到Cl2 (2分)
(5)NaClO2變質前后分別與Fe2+反應時,最終均得到等量NaCl,Cl元素均由+3價變為-1價,根據電子守恒,兩個過程中得到的電子的物質的量相同(2分)
【解析】
試題分析:(1)Ⅰ中發生的反應是亞硫酸鈉被氯酸鈉氧化,、Ⅲ中發生的反應是電解水,因此在這兩個反應中還原劑分別是:Na2SO3 H2O(2分)
(2)2ClO2 + H2O2 + 2OH- = 2ClO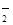 + O2↑+ 2H2O(2分)
+ O2↑+ 2H2O(2分)
(3)Ⅲ裝置中左邊氫氧根離子放電,剩余的氫離子跟硫酸根離子結合成硫酸,所以A是:H2SO4; 因為是氫氧根離子放電,所以這邊是電解池的陽極。
(4)在這個反應中發生的是亞氯酸鈉中氯元素的自身氧化還原反應,既作氧化劑,也作還原劑,作氧化劑的亞氯酸鈉是化合價降低的,也就是由正三價變成正一價,為一摩爾,作還原劑的亞氯酸鈉是化合價升高的,也就是由正三價變成正四價,為四摩爾,所以該反應中氧化劑和還原劑的物質的量之比是1∶4 ;ClO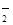 的氧化性或Cl-的還原性隨溶液的酸性和濃度的增大而增強,因此Cl-被氧化得到Cl2 。
的氧化性或Cl-的還原性隨溶液的酸性和濃度的增大而增強,因此Cl-被氧化得到Cl2 。
(5)NaClO2變質前后分別與Fe2+反應時,最終均得到等量NaCl,Cl元素均由+3價變為-1價,根據電子守恒,兩個過程中得到的電子的物質的量相同(2分)
考點:氧化還原反應的有關知識。


 浙江名校名師金卷系列答案
浙江名校名師金卷系列答案科目:高中化學 來源: 題型:
 (2013?江西模擬)已知Ca(OH)2與Cl2反應的氧化產物與溫度有關,在一定量的石灰乳中通入一定量的氯氣,二者恰好完全反應(發生的反應均為放熱反應).生成物中含有Cl-、ClO-、Cl
(2013?江西模擬)已知Ca(OH)2與Cl2反應的氧化產物與溫度有關,在一定量的石灰乳中通入一定量的氯氣,二者恰好完全反應(發生的反應均為放熱反應).生成物中含有Cl-、ClO-、Cl| O | - 3 |
| O | - 3 |
| O | n- 4 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 壓強MPa 轉化率% 溫度℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
查看答案和解析>>
科目:高中化學 來源:2012屆福建省三明市普通高中高三上學期聯合命題考試化學試卷 題型:填空題
(10分)氯氣是氯堿工業的主要產品之一,它是一種常用的消毒劑,其消毒原理是與水反應生成了次氯酸:
Cl2 + H2O  HCl + HClO K=4.5×10-4
HCl + HClO K=4.5×10-4
次氯酸的強氧化性能殺死水中的病菌(不直接用次氯酸為自來水消毒是因為次氯酸易分解,且毒性較大)。但是,由于氯氣貯運不方便,且具有一定的危險性,目前正逐漸被其它性能優越的消毒產品所替代。請回答:
(1)氯堿工業生產氯氣的化學方程式為 。
(2)84消毒液(主要成分為NaClO)與氯氣相比具有貯運方便等優點,用氯氣與燒堿溶液反應制備84消毒液的離子方程式為 。
(3)二氧化氯是一種高效、廣譜、安全的殺菌、保鮮劑。我國科學家研發了用氯氣氧化亞氯酸鈉(NaClO2)固體制備二氧化氯的方法,其化學方程式為 。
(4)一位同學設計了一套用濃鹽酸和KMnO4固體制取少量氯氣并比較氯氣與碘單質的氧
化性強弱的微型裝置(如圖)。
①下列溶液能吸收Cl2的是 (填字母序號)。
| A.飽和食鹽水 | B.飽和Na2SO3溶液 |
| C.飽和NaOH溶液 | D.濃硫酸 |
查看答案和解析>>
科目:高中化學 來源:2013-2014學年貴州省銅仁市高三第四次月考理綜化學試卷(解析版) 題型:選擇題
已知向氯酸鈉的酸性水溶液中通入二氧化硫氣體,反應中SO2氧化過程為:SO2+2H2O –2e- =SO42-+4H+;向亞氯酸鈉(NaClO2)固體中通入用空氣稀釋的氯氣,反應中還原過程為:Cl2 + 2 e- =2Cl-。在上述兩個反應中均會生成產物X,則X的化學式為( )
A.ClO2 B.NaClO4 C.HClO D. NaClO
查看答案和解析>>
科目:高中化學 來源:2011-2012學年福建省三明市高三上學期聯合命題考試化學試卷 題型:填空題
(10分)氯氣是氯堿工業的主要產品之一,它是一種常用的消毒劑,其消毒原理是與水反應生成了次氯酸:
Cl2 + H2O
 HCl
+ HClO K=4.5×10-4
HCl
+ HClO K=4.5×10-4
次氯酸的強氧化性能殺死水中的病菌(不直接用次氯酸為自來水消毒是因為次氯酸易分解,且毒性較大)。但是,由于氯氣貯運不方便,且具有一定的危險性,目前正逐漸被其它性能優越的消毒產品所替代。請回答:
(1)氯堿工業生產氯氣的化學方程式為 。
(2)84消毒液(主要成分為NaClO)與氯氣相比具有貯運方便等優點,用氯氣與燒堿溶液反應制備84消毒液的離子方程式為 。
(3)二氧化氯是一種高效、廣譜、安全的殺菌、保鮮劑。我國科學家研發了用氯氣氧化亞氯酸鈉(NaClO2)固體制備二氧化氯的方法,其化學方程式為 。
(4)一位同學設計了一套用濃鹽酸和KMnO4固體制取少量氯氣并比較氯氣與碘單質的氧
化性強弱的微型裝置(如圖)。

①下列溶液能吸收Cl2的是 (填字母序號)。
A. 飽和食鹽水 B. 飽和Na2SO3溶液
C. 飽和NaOH溶液 D. 濃硫酸
②能說明Cl2的氧化性強于I2的實驗現象是 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com