
【題目】某溫度下,BaSO4在水中的沉淀溶解平衡曲線如圖所示。下列說法正確的是( )

A. 該溫度下,BaSO4的Ksp=8×10﹣10 B. M點和P點對應的Ksp相等
C. N點無BaSO4沉淀生成 D. 加入Na2SO4可以使溶液由Q點變到P點
 教材全解字詞句篇系列答案
教材全解字詞句篇系列答案科目:高中化學 來源: 題型:
【題目】電解質水溶液中存在電離平衡、水解平衡等,請回答下列問題。
(1)已知部分弱電解質的電離常數如下表:
弱電解質 | NH3.H2O | HCOOH | HCN | H2CO3 |
電離常數(25℃) | Kb = 1.8×10 5 | Ka = 1. 77×10 4 | Ka=4.3×1010 | Ka1=5.0×107 Ka2=5.6×1011 |
① 已知25℃時,HCOOH( aq) +OH ( aq)=HCOO(aq) +H2O(l) △H=a kJ/mol H+(aq) +OH(aq) =H2O(l) △H=b kJ/mol 甲酸電離的熱化學方程式為______________。
②取濃度相同的上述三種酸溶液,溶液pH最大的是_________,稀釋相同的倍數后,溶液pH變化最大的是____________________。
③分別取等濃度、等體積HCOOH和HCN溶液,加入同濃度的NaOH溶液中和,當溶液呈中性時消耗NaOH溶液的體積:V (HCOOH)______ V (HCN) (填“>”、“<”或“=”)。
④0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN)______c(HCO3 )(填“>”、“<”或“=”)。
⑤常溫下,pH相同的三種溶液a.HCOONa b.NaCN c.Na2CO3,其物質的量濃度由大到小的順序是_____________(填編號)。
⑥將少量CO2通入NaCN溶液,反應的離子方程式是__________________________________。
⑦若NH3·H2O與CO2恰好完全反應生成正鹽,則此時溶液呈________性(填“酸”或“堿”)。向該溶液中通入________氣體可使溶液呈中性(填“CO2”或“NH3”)。此時溶液中c(NH4+)/c(CO3 2) ________2(填“>”“<”或“=”)
(2)室溫下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的變化曲線如圖所示。

① HA的電離方程式是____________________________
② a、b、c處溶液中水的電離程度最大的是_______________
③ c點所示的溶液中除水分子外的微粒濃度由大到小的順序依次為______________________________。
(3)常溫下,將等體積0.1 molL-1NaOH和n molL-1HA混合,溶液呈中性,該溫度下HA的電離常數Ka=___________(用含有n的式子表達)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】世界某著名學術刊物介紹了一種新型中溫全瓷鐵空氣電池,其結構如圖所示。

下列有關該電池放電時的說法正確的是( )
A.a極發生氧化反應
B.正極的電極反應式為FeOx+2xe-=Fe+xO2-
C.若有22.4 L(標準狀況)空氣參與反應,則電路中有4 mol電子轉移
D.鐵表面發生的反應為xH2O(g)+Fe=FeOx+xH2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關說法正確的是
A. 用新制Cu(OH)2懸濁液檢驗牙膏中的甘油時,可生成絳藍色沉淀
B. 用紙層析法分離Cu2+和Fe3+,為了看到色斑,必須通過氨熏
C. 氯化鉆濃溶液加水稀釋,溶液的顏色由藍色逐漸轉變為粉紅色
D. 摘下幾根火柴頭,浸于水中,片刻后取少量溶液于試管中,加AgNO3溶液和稀硝酸,若出現白色沉淀,說明火柴頭中含氯元素
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業食鹽中含Ca2+、Mg2+等雜質,某廠電解飽和食鹽水制取NaOH溶液的工藝流程如圖所示,回答下列問題:
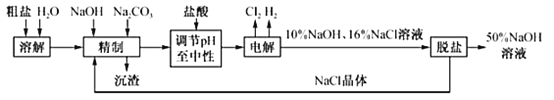
(1)“精制”過程中發生反應的離子方程式為_____
(2)若粗鹽中SO42﹣含量也較高,沉淀劑可以是_____(填字母)且要在試劑Na2CO3之_____加入(填“前”或“后”)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(3)在電解過程中,產生H2的電極與外接電源的_____極相連;溶液pH增大的區域是_____(填“陽極區”或“陰極區”)。
(4)燒堿和氯氣是電解飽和食鹽水時按照固定的比率k(質量比)生成的產品。理論上k=_____(填寫計算表達式和結果且結果保留兩位小數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素X、Q、Y、Z、M、R均為短周期主族元素,且原子序數依次增大。已知Y原子最外層電子數與核外電子總數之比為3︰4,M原子的最外層電子數與次外層電子數之比為3︰4;R-、Z+、X+離子半徑逐漸減小;化合物XR常溫下為氣體,Q和Y在周期表中的位置相鄰。請回答下列問題。
(1)M在元素周期表中的位置是___,寫出Z的離子結構示意圖:__;Q的簡單氫化物的結構式為___。
(2)寫出X、Y、R按原子個數之比1︰1︰1形成的化合物的化學式:___。
(3)X與Y可分別形成10電子和18電子的分子,寫出該18電子分子轉化成10電子分子的化學方程式:___。
(4)寫出單質R的一種工業用途:___。
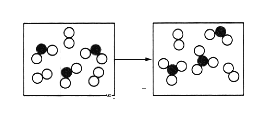
(5)如圖表示由上述元素中的某兩種元素組成的氣體分子在一定條件下的密閉容器中充分反應前后的轉化關系,寫出該轉化過程的化學方程式:___。
(6)科學家認為存在QX5這種物質,且預測其與水劇烈反應放出氣體,所得水溶液呈弱堿性,寫出該反應的化學方程式:___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的值,下列敘述正確的是( )
A.物質的量濃度為0.5 mol/L的MgCl2溶液中,含有Cl﹣的數目為 NA
B.0.2 mol Fe與足量水蒸氣反應,生成的H2分子數目為0.3 NA
C.標準狀況下,22.4LH2O含有的分子數為NA
D.一定條件下2.3gNa與一定量氧氣反應生成Na2O和Na2O2的混合物,轉移的電子數一定為0.1NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不能夠用勒夏特勒原理來解釋的是
A. 實驗室用排飽和食鹽水的方法收集氯氣
B. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,當加入硝酸銀溶液后(AgBr是淡黃色沉淀),溶液顏色變淺
HBr+HBrO,當加入硝酸銀溶液后(AgBr是淡黃色沉淀),溶液顏色變淺
C. SO2催化氧化制SO3的過程中使用過量的氧氣,以提高二氧化硫的轉化率
D. 恒溫、恒壓條件下,在2NO2![]() N2O4平衡體系中充入He后,體系顏色變淺
N2O4平衡體系中充入He后,體系顏色變淺
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】若一個氖原子質量是a g,一個12C原子質量是b g,設阿伏加德羅常數的數值為NA,下列說法不正確的是 ( )
A. 該氖原子的相對原子質量是12a/bB. 該氖原子的摩爾質量是aNAg
C. Wg該氖原子的物質的量是![]() molD. Wg該氖原子所含質子數是10W/a
molD. Wg該氖原子所含質子數是10W/a
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com