
下列變化不能用勒夏特列原理解釋的是( )
A.向H2S水溶液中加入NaOH有利于S2-增多
B.H2、I2、HI 混合氣體加壓后顏色變深
C.合成氨時將氨液化分離,可提高原料的利用率
D.新制氯水久置后顏色變淺
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2016-2017學年浙江省溫州市十校聯合體高二上期末化學試卷(解析版) 題型:填空題
研究NO2、SO2、CO等大氣污染氣體的處理具有重要意義。
(1)已 知:2SO2(g)+O2(g)
知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6kJ·mol-1
2SO3(g) ΔH=-196.6kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0kJ·mol-1
2NO2(g) ΔH=-113.0kJ·mol-1
則反應NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=____________ kJ·mol-1。
SO3(g)+NO(g)的ΔH=____________ kJ·mol-1。
(2)一定條件下,將NO2與SO2以體積比2∶1置于密閉容器中發生上述反應,下列能說明反應達到平衡狀態的是____________。
A.體系壓強保持不變 B.混合氣體顏色保持不變
C.SO3和NO的體積比保持不變 D.每消耗1molSO3的同時生成1mol NO
若測得上述反應達平衡時NO2與SO2的體積比為5∶1,則平衡常數K= 。
(3)CO可用于合成甲醇,反應方程式為CO(g)+2H2(g) CH3OH(g
CH3OH(g )。CO在不同溫度下的平衡轉化率與壓強的關系如圖甲所示。該反應ΔH________0(填“>”或“<”)。
)。CO在不同溫度下的平衡轉化率與壓強的關系如圖甲所示。該反應ΔH________0(填“>”或“<”)。
圖甲: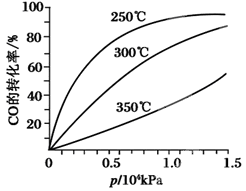 圖乙:
圖乙: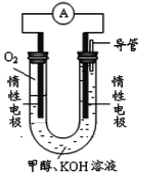
(4)依據燃燒的反應原理,合成的甲醇可以設計如圖乙所示的原電池裝置。
①該電池工作時,OH-向_______極移動(填“正”或“負”)。
②該電池正極的電極反應式為______________________。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年天津市高一上期末化學卷(解析版) 題型:選擇題
為了使宇航員在飛船中得到一個穩定的、良好的生存環境,一般在飛船內安裝了盛有Na2O2(或 K2O2)顆粒的裝置,它的用途是產生氧氣。下列有關 Na2O2的敘述正確的是
A.Na2O2中陰、陽離子的個數比是 1∶1
B.Na2O2分別與水及CO2反應產生相同量氧氣時,需水和 CO2的質量相等
C.Na2O2的漂白原理與 SO2的漂白原理相同
D.與 CO2、H2O反應產生等量氧氣,轉移電子數相同,耗Na2O2的質量相同
查看答案和解析>>
科目:高中化學 來源:2016-2017學年安徽省等名校高二上期末化學卷(解析版) 題型:填空題
氮元素可形成多種化合物,在工業生產中具有重要價值。 請回答下列問題:
(1)已知拆開1molH-H 鍵,1molN-H鍵, 1molN≡N鍵分別需要的能量是436kJ、391kJ、946kJ,則N2與H2反應合成NH3的熱化學方程式為 ______________________。
(2)一定溫度下,2L密閉容器中充入0.40 mol N2O4,發生反應:N2O4(g) 2NO2(g),一段時間后達到平衡,測得數據如下:
2NO2(g),一段時間后達到平衡,測得數據如下:
時間/s | 20 | 40 | 60 | 80 | 100 |
C(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
①20 s內,v(NO2)=___________mol·L-1·s-1。
②升高溫度時,氣體顏色加深,則正反應是_________(填“放熱”或“吸熱”)反應。
③該溫度下反應的化學平衡常數數值為_____________。
④相同溫度下,若開始向該容器中充入0.80molNO2,則達到平衡后: c(NO2) ______ 0.30mol·L-1(填“>”、 “=”或“<”)
(3)N2O5是一種新型硝化劑,其性質和制備受人們關注。現以 H2、O2、熔融鹽 Z(Na2CO3)組成的燃料電池電解制備N2O5,裝置如圖所示,其中Y為CO2。
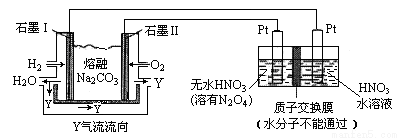
①寫出石墨I電極上發生反應的電極反應式 _____________________________;
②在電解池中生成N2O5的電極反應式為 ____________________________
查看答案和解析>>
科目:高中化學 來源:2016-2017學年安徽省等名校高二上期末化學卷(解析版) 題型:選擇題
在一定溫度下,將氣體 X 和氣體Y各0.16 mol 充入10 L恒容密閉容器中,發生反應X(g)+Y(g)  2Z(g) ΔH<0,一段時間后達到平衡。反應過程中測定的數據如下表:
2Z(g) ΔH<0,一段時間后達到平衡。反應過程中測定的數據如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列說法正確的是 ( )
A.反應前2 min 的平均速率 v(Z)=2.0×10-3mol·L-1·min-1
B.其他條件不變,降低溫度,反應達到新平衡前 v(逆)>v(正)
C.該溫度下此反應的平衡常數 K=1.44
D.其他條件不變,再充入 0.2 mol Z,平衡時X的體積分數增大
查看答案和解析>>
科目:高中化學 來源:2016-2017學年安徽省等名校高二上期末化學卷(解析版) 題型:選擇題
由反應物 X 分別轉化為 Y 和 Z 的能量變化如圖所示。下列說法正確的是( )
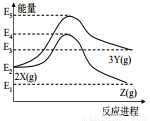
A.由 X→Z 反應的 ΔH<0 B.由 X→Y 反應的 ΔH=E5-E2
C.增大壓強有利于提高 Y 的產率 D.升高溫度有利于提高 Z 的產率
查看答案和解析>>
科目:高中化學 來源:2016-2017學年四川省樂山市高二上學期期末化學試卷(解析版) 題型:填空題
(1)請將下列變化過程中破壞的微粒間作用力名稱的編號填在橫線上:
A共價鍵 B離子鍵 C金屬鍵 D分子間作用力
氫氧化鈉熔化 ;②干冰升華 ;
③二氧化硅熔化 ;④鈉熔化 。
(2)單質硼有無定形和晶體兩種,參考下表數據。
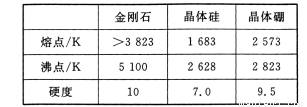
①根據表中數據判斷晶體硼的晶體類型屬于 晶體;
②請解釋金剛石的熔沸點高于晶體硅的原因是 。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年四川省簡陽市高二上學期期末化學試卷(解析版) 題型:填空題
(1)甲醇(CH3OH)是一種重要的化工原料,廣泛應用于化工生產,也可以直接用做燃料。已知:甲醇的燃燒熱486為kJ·mol-1 ( 2CO (g) + O2(g) = 2CO2(g) △H b =-566.0 kJ·mol-1)
試寫出CH3OH(l)在氧氣中完全燃燒生成CO和H2O(l)的熱化學方程式: 。
(2)常溫下某溶液中由水電離的c(H+)=10-10 mol/L,則該溶液的pH為 _______。
(3)常溫下,向V L pH=12的Ba(OH)2溶液中逐滴加入一定濃度的NaHSO4稀溶液,當溶液中的Ba2+恰好沉淀完全時,溶液pH=11。則Ba(OH)2溶液與NaHSO4溶液的體積比為__________,NaHSO4溶液的物質的量濃度為 。
(4)常溫下,0.5mol/L的NH4Cl溶液的為pH=5.該溶液顯酸性的原因是(用離子方程式表示) 。計算常溫下氨水的電離平衡常數為 。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年四川省廣安市高一上學期期末化學試卷(解析版) 題型:選擇題
下列各組中的離子,能在無色溶液中大量共存的是
A.H+、 K+、 CO32-、 SO42- B.Fe3+、Na+、NO3-、SO42-
C.Mg2+、Ba2+、OH-、NO3-  D.K+、Mg2+、NO3-、Cl-
D.K+、Mg2+、NO3-、Cl-
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com