
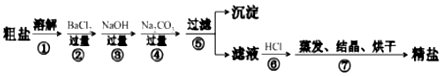
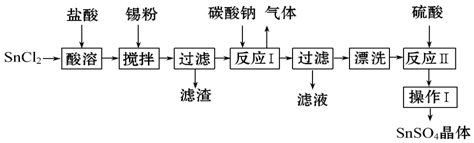
分析 根據除去粗鹽中的泥沙、CaCl2、MgCl2、Na2SO4雜質,即除去鎂離子、鈣離子和硫酸根離子和泥沙,鎂離子用氫氧根離子沉淀,硫酸根離子用鋇離子沉淀,鈣離子用碳酸根離子沉淀,樣品溶解之后,可先加入氫氧化鈉除去氯化鎂,再加入氯化鋇除去硫酸鈉,或先加入氯化鋇除去硫酸鈉,再加入氫氧化鈉除去氯化鎂,最后加入碳酸鈉,以除去CaCl2和過量的BaCl2,過濾要放在所有的沉淀操作之后,最后再用鹽酸處理溶液中的碳酸根離子和氫氧根離子,最后戶進行蒸發、結晶、烘干等操作得到精鹽,以此解答該題.
解答 解:(1)用玻璃棒攪拌,加速了液體的流動,使固體很快溶解,故答案為:加速溶解;
(2)檢驗硫酸根離子,可用氯化鋇檢驗,生成白色沉淀,方法是取少量上層清液置于試管中,滴加BaCl2溶液,看是否有白色沉淀生成,
故答案為:取少量上層清液置于試管中,滴加BaCl2溶液,看是否有白色沉淀生成;
(3)碳酸鈉會與氯化鋇生成碳酸鋇沉淀和氯化鈉,碳酸鈉會與氯化鈣反應生成碳酸鈣沉淀和氯化鈉,所以第④步操作加入過量的 Na2CO3目的是除去CaCl2、BaCl2,發生CaCl2+Na2CO3═CaCO3↓+2NaCl;BaCl2+Na2CO3═BaCO3↓+2NaCl,
故答案為:CaCl2;BaCl2;CaCl2+Na2CO3═CaCO3↓+2NaCl;BaCl2+Na2CO3═BaCO3↓+2NaCl;
(4)第④步操作后生成Mg (OH)2、CaCO3、BaCO3,如加入鹽酸,都與鹽酸反應,則沉淀溶解,故答案為:溶解Mg (OH)2、CaCO3、BaCO3.
點評 本題考查粗鹽的提純,為高考常見題型,側重于學生的分析、實驗能力的考查,把握流程中試劑的加入發生的化學反應及操作為解答的關鍵,注重實驗的嚴密性和溶液的配制、物質提純的考查,題目難度中等.


科目:高中化學 來源: 題型:解答題
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
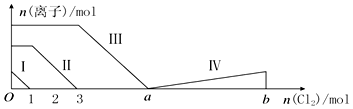
| A. | 線段Ⅱ表示Br-的變化情況 | |
| B. | 線段Ⅳ表示IO3-的變化情況,其中IO3-增加了5moL. | |
| C. | a=6 | |
| D. | 原溶液中n(FeI2):n(FeBr2)=3:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
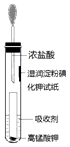 氯氣貯運不方便,且具有一定的危險性,目前正逐漸被其他性能優越的消毒產品所替代.請回答:
氯氣貯運不方便,且具有一定的危險性,目前正逐漸被其他性能優越的消毒產品所替代.請回答:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 對于C2H4 (g)+H2O(g)?C2H5OH(g),在一定條件下達到平衡狀態時,體系的總壓強為P,其中C2H4(g)、H2O(g)、C2H5OH(g)均為2 mol,則用分壓表示的平衡常數Kp=$\frac{3}{P}$ | |
| B. | 恒溫恒壓下,在一容積可變的容器中,N2(g)+3H2(g)?2NH3(g)達到平衡狀態時,N2、H2、NH3各1mol,若此時再充入3mol N2,則平衡正向移動 | |
| C. | 恒溫恒壓下,在一容積可變的容器中,反應2A(g)+B(g)?2C(g)達到平衡時,A、B和 C的物質的量分別為4mol、2mol和4mol,若此時A、B和C均減少1 mol,平衡逆向移動 | |
| D. | 對于一定條件下的某一可逆反應,用平衡濃度表示的平衡常數和用平衡分壓表示的平衡常數,其數值不同,但意義相同,都只與溫度有關 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CaCO3$\frac{\underline{\;高溫\;}}{\;}$CaO+CO2↑ | B. | Na2O+H2O=2NaOH | ||
| C. | Na2CO3+2HCl=2NaCl+H2O+CO2↑ | D. | 4HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com