
【題目】有關氧化還原反應的下列說法正確的是
A.一種元素被氧化,肯定有另一種元素被還原
B.反應中轉移電子的數目等于得電子總數與失電子總數之和
C.氧化劑中的元素化合價不一定都降低
D.氧化劑具有氧化性,發生氧化反應
 作業輔導系列答案
作業輔導系列答案 同步學典一課多練系列答案
同步學典一課多練系列答案科目:高中化學 來源: 題型:
【題目】對下列四種有機物的有關說法正確的是
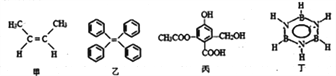
A. 甲的名稱為反-2-丁烯
B. 乙中所有碳原子一定處于同一平面
C. 1mol丙分別與足量Na、NaOH、NaHCO3反應,消耗這三種物質分別是3mol、4mol、1mol
D. 丁的二氯代物有3種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)在標準狀況下,CO和CO2的混合氣體共39.2 L,質量為61 g。則兩種氣體的物質的量之和為________mol。其中CO2為________mol,CO占總體積的________%。
(2)448 mL某氣體在標準狀況下的質量為1.28 g,則該氣體的相對分子質量為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在25 ℃、101 kPa條件下,將15 L O2通入10 L CO和H2的混合氣體中,使其完全燃燒,干燥后,恢復至原來的溫度和壓強。
(1)若剩余氣體的體積是15 L,則原CO和H2的混合氣體中V(CO)=________ L,V(H2)=________ L。
(2)若剩余氣體的體積為a L,則原CO和H2的混合氣體中V(CO)∶V(H2)=________。
(3)若剩余氣體的體積為a L,則a的取值范圍是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據要求寫出方程式
(1)寫出鋁與氫氧化鈉溶液反應的離子方程式_________________________________。
(2)過氧化鈉與水反應的離子方程式__________________________________。
(3)工業上制取漂白粉的化學方程式為___________________________________。
(4)向硫酸亞鐵溶液中滴加氫氧化鈉溶液,邊加邊振蕩,未得到白色沉淀的原因是發生了_______反應(寫出反應的化學方程式)。
(5)氨的催化氧化反應的化學方程式為___________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列說法正確的是( )
A. 常溫常壓下,16 g CH4中含有4NA個C—H鍵
B. 1 mol·L-1 NaCl溶液中含有NA個Na+
C. 1 mol Cu與足量的稀硝酸反應產生NA個NO分子
D. 標準狀況下,22.4 L氦氣中含有2NA個He原子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】砷化鎵(GaAs)是優良的半導體材料,可用于制作微型激光器或太陽能電池的材料等。回答下列問題:
(1)寫出基態As原子的核外電子排布式________________________。
(2)根據元素周期律,原子半徑Ga_____________As,第一電離能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立體構型為____________________,其中As的雜化軌道類型為_________。
(4)GaF3的熔點高于1000℃,GaCl3的熔點為77.9℃,其原因是_____________________。
(5)GaAs的熔點為1238℃,密度為ρg·cm-3,其晶胞結構如圖所示。該晶體的類型為________________,Ga與As以________鍵鍵合。Ga和As的摩爾質量分別為MGa g·mol-1和MAs g·mol-1,原子半徑分別為rGa pm和rAs pm,阿伏伽德羅常數值為NA,則GaAs晶胞中原子的體積占晶胞體積的百分率為____________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溶液中只含有Ba2+ Mg2+ Ag+三種陽離子,現用適量的NaOH溶液、稀鹽酸和Na2SO4溶液將這三種離子逐一沉淀分離,其流程如圖所示:
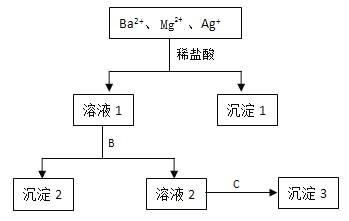
(1)沉淀1的化學式為 ,生成該沉淀的離子方程式為 。
(2)若試劑B為Na2SO4溶液,則沉淀2化學式為 。
(3)若試劑B為NaOH溶液,則生成沉淀2的離子方程式為 。
(4)如果原溶液中Ba2+ Mg2+ Ag+的濃度均為0.1 mol·L-1,且溶液中含有的陰離子只有NO3-,則溶液中NO3- 濃度為 mol·L-1。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com