
【題目】完成下反應的化學方祝式或離子方程式:
(1)鋁與黑色鐵的化合物(有磁性)反應_____________。
(2)工業上制粗硅的反應____________。
(3)硫酸鋁溶液中加入過量氨水的離子方程式____________。
(4)用稀鹽酸清洗銅器皿表面上的銅銹的離子方程式:____________。
【答案】 8Al+3Fe3O4![]() 9Fe+4Al2O3 SiO2+2C
9Fe+4Al2O3 SiO2+2C![]() Si+2CO↑ Al3++3NH3·H2O=Al(OH)3↓+3NH4+ Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O
Si+2CO↑ Al3++3NH3·H2O=Al(OH)3↓+3NH4+ Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O
【解析】(1)鋁與黑色鐵的化合物(有磁性,說明是四氧化三鐵)反應的方程式為8Al+3Fe3O4![]() 9Fe+4Al2O3;(2)工業上利用焦炭和二氧化硅反應制粗硅,反應的方程式為SiO2+2C
9Fe+4Al2O3;(2)工業上利用焦炭和二氧化硅反應制粗硅,反應的方程式為SiO2+2C![]() Si+2CO↑;(3)硫酸鋁溶液中加入過量氨水的離子方程式為Al3++3NH3·H2O=Al(OH)3↓+3NH4+ ;(4)銅銹的主要成分是堿式碳酸銅,則用稀鹽酸清洗銅器皿表面上的銅銹的離子方程式為Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O。
Si+2CO↑;(3)硫酸鋁溶液中加入過量氨水的離子方程式為Al3++3NH3·H2O=Al(OH)3↓+3NH4+ ;(4)銅銹的主要成分是堿式碳酸銅,則用稀鹽酸清洗銅器皿表面上的銅銹的離子方程式為Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O。


科目:高中化學 來源: 題型:
【題目】在一定條件下,對于A2(g)+3B2(g)![]() 2AB3(g)反應來說,以下化學反應速率的表示中,化學反應速率最快的是
2AB3(g)反應來說,以下化學反應速率的表示中,化學反應速率最快的是
A.v(A2)=0.8 mol·L-1·s-1 B.v(A2)=30 mol·L-1·min-1
C.v(AB3)=1.0 mol·L-1·s-1 D.v(B2)=1.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D均為中學所學的常見物質且均含有同一種元素,它們之間的轉化關系如下圖所示(反應條件及其他物質已經略去):![]()
(1)若A為H2S,D的水溶液能使濕潤的藍色石蕊試紙變紅,B為刺激性氣味氣體,寫出B→C轉化的化學反應方程式:________________________________________。
(2)若A的水溶液能使濕潤的紅色石蕊試紙變藍,D的稀溶液能使濕潤的藍色石蕊試紙變紅:A的化學式為______,實驗室制備氣體A的化學反應方程式__________________________,A→B轉化的化學方程式為_____________________________________________________。
(3)若A為活潑金屬元素的單質,D為強堿,焰色反應顯黃色,則B是(填化學式)________, C可作為呼吸面具的填充劑,C與二氧化碳發生反應的化學方程式為________________________________,C與水發生反應的離子方程式為___________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在反應3Cu +8HNO3(稀) == 3Cu(NO3)2 + 2NO↑ +4H2O 中
(1)用單線橋標出電子轉移___________________________
(2)還原劑是__________,被還原的元素是__________,還原產物是__________。
(3)若生成2mol的NO氣體,溶液中生成的Cu2+為___________mol。
(4)在反應中硝酸顯示_________性和____________性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】蓋斯定律在生產和科學研究中有很重要的意義。有些反應的反應熱雖然無法直接測得,但可通過間接的方法測定。現根據下列的3個熱化學反應方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol
Fe2O3(s)+![]() CO(g)=
CO(g)=![]() Fe3O4(s)+
Fe3O4(s)+![]() CO2(g)△H=-15.73kJ/mol
CO2(g)△H=-15.73kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.4kJ/mol
試寫出CO氣體還原FeO固體得到Fe固體和CO2氣體的熱化學反應方程式: 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗小組只領取下列儀器或用品:鐵架臺、鐵圈、鐵夾、三腳架、石棉網、燒杯、漏斗、分液漏斗、酒精燈、玻璃棒、量筒、蒸發皿、圓底燒瓶、火柴、濾紙。只應用上述儀器或用品,不能進行的實驗操作是( )
A. 蒸發 B. 萃取 C. 過濾 D. 蒸餾
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳及其含碳化合物在人們的生產生活中應用廣泛。
(1)將不同量的CO2(g)和H2(g)分別通入到體積為2L的恒容密閉容器中,進行反應2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g),得到如表三組數據;
實驗組 | 溫度℃ | 起始量/mol | 平衡量/mol | 達到平衡所需 時間/min | ||
CO2 | H2 | H2 | C2H5OH | |||
1 | 650 | 2 | 6.8 | 2.0 | 0.8 | 6 |
2 | 900 | 2 | 4.4 | 2.0 | 0.4 | 3 |
3 | 900 | 4 | 8.8 | C | d | t |
①實驗1中以v(H2)表示的反應速率為________________
②已知在一定溫度下,當一個可逆反應達到化學平衡時,生成物濃度冪之積與反應物濃度冪之積的比值是一個常數稱之為化學平衡常數。900℃化學平衡常數為______________,
③如果改變影響平衡的條件之一(如溫度,壓強,反應物的濃度)平衡將向著能夠減弱這種改變的方向移動。則第3組與第2組相比CO2的轉化率___________(填“增大”“減小”“不變” 不能確定).
(2)將CH4設計成燃料電池,其利用率更高,裝置示意如圖(A、B為多孔性碳棒). 持續通入甲烷,在標準狀況下,消耗甲烷體積VL.
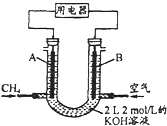
①0<V![]() 44.8L時,負極電極反應為_________________
44.8L時,負極電極反應為_________________
②44.8L<V![]() 89.6L時,電池總反應方程式為_____________
89.6L時,電池總反應方程式為_____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在“綠色化學”工藝中,理想狀態是反應物中的原子全能轉化目標產物,即原子利用率為100%。在下列反應類型中,不能體現這一原子最經濟性原則的是
A. 化合反應 B. 加聚反應 C. 加成反應 D. 消去反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com