
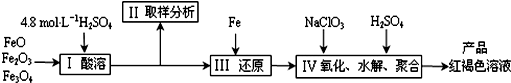
分析 (1)根據配制一定量分數溶液的步驟:計算、稱量、溶解,確定所用的儀器;
(2)滴定過程中產生的誤差依據滴定原理就是式分析,c(待測)=$\frac{c(標準)V(標準)}{V(待測)}$,把產生的誤差全部歸納為標準溶液消耗的體積判斷產生的誤差;
(3)根據氧化還原反應中化合價升降相等以及電荷守恒、質量守恒來解答,從環保和成本方面考慮;
(4)①判斷SO42-離子已沉淀完全的方法是取上層清夜,滴加BaCl2溶液,若無沉淀產生,則溶液中SO42-已沉淀完全;
②達到終點時高錳酸鉀過量,溶液由淺藍色變為淺紫紅色,且半分鐘內不變色;
③分別求出聚合硫酸鐵中SO42-與Fe3+的物質的量(用含m、V的代數式表示).
解答 解:(1)配制一定量分數硫酸溶液需要的儀器有:膠頭滴管、量筒、玻璃棒、燒杯.
故答案為:250mL容量瓶、膠頭滴管;
(2)因滴定過程中產生的誤差依據滴定原理就是式分析,c(待測)=$\frac{c(標準)V(標準)}{V(待測)}$,
A.用量筒量取濃硫酸時,俯視讀數,量取的濃硫酸體積減小,配制得到的溶液濃度減小,故A錯誤;
B.把量筒中的濃硫酸轉移到燒杯中稀釋后,用少量蒸餾水洗滌一下量筒內壁,同時把洗滌液也轉移到燒杯中,避免了溶質的損失,故B正確;
C.稀釋后的硫酸溶液及時用玻璃棒引流轉移到容量瓶中,硫酸溶解放熱形成的熱溶液未經冷卻,會導致溶液體積增大,冷卻到常溫下容量瓶中 溶液體積未達到刻度,溶液濃度增大,故C正確;
D.移液時容量瓶內壁未干燥,殘留有水,對測定結果無影響,故D錯誤;
故答案為:BC;
(3)Fe2+由+2價升高到+3價,ClO3-中Cl的化合價從+5價降低到-1價,得6Fe2++ClO3-+H+--6Fe3++Cl-,由電荷守恒、質量守恒得:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O,從環保和成本方面考慮利是原料成本較低,弊是產生氣體對大氣有污染.
故答案為:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O; 原料成本較低;產生氣體對大氣有污染;
(4))①判斷SO42-離子已沉淀完全的方法是取上層清夜,滴加BaCl2溶液,若無沉淀產生,則溶液中SO42-已沉淀完全,
故答案為:取上層清夜,滴加BaCl2溶液,若無沉淀產生,則溶液中SO42-已沉淀完全;
②達到終點時高錳酸鉀過量,溶液由淺藍色變為淺紫紅色,且半分鐘內不變色,
故答案為:溶液由淺藍色變為淺紫紅色,且半分鐘內不變色
③25mL溶液中含聚合硫酸鐵中SO42-的物質的量為:$\frac{m}{233}$mol,
設Fe3+的物質的量為x:
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
1 5
0.1mol/L×0.001VL $\frac{x}{10}$
解得x=$\frac{V}{200}$mol,
聚合硫酸鐵中SO42-與Fe3+的物質的量之比為$\frac{m}{233}$:$\frac{V}{200}$,
故答案為:$\frac{m}{233}$:$\frac{V}{200}$.
點評 本題以鐵及其化合物為載體,以流程圖形式考查了氧化還原反應知識、元素化合物的知識,注意風險過程和實驗基本操作的分析,掌握基礎是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SiO2與CaCl2溶液不反應,而CO2通入CaCl2溶液中可得到白色沉淀 | |
| B. | CO2通入到水玻璃中可以得到硅酸 | |
| C. | CO2與SiO2在物理性質上差別很大 | |
| D. | CO2和SiO2都是酸性氧化物,都能與NaOH溶液反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 物質的量濃度相等的碳酸氫鋇溶液和氫氧化鈉溶液等體積混合Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O | |
| B. | NaHSO4溶液中滴加入Ba(OH)2溶液至中性:2H++Ba2++2OH-+SO42-=BaSO4↓+2H2O | |
| C. | 以石墨作電極電解氯化鎂溶液:2Cl-+2H2O═2OH-+H2↑+Cl2↑ | |
| D. | 碳酸氫鈉溶液加入氯化鋁溶液 3HCO3-+Al3+?3CO2↑+Al(OH)3↓ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  圖中△H1=△H2+△H3 | |
| B. |  如圖在催化劑條件下,反應的活化能等于E1+E2 | |
| C. |  如圖表示醋酸溶液滴定 NaOH 和氨水混合溶液的電導率變化曲線 | |
| D. |  如圖可表示由CO(g)生成CO2(g)的過程中要放出566kJ 熱量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氫鍵比分子間作用力強,所以它屬于化學鍵 | |
| B. | 分子內形成的氫鍵使物質的熔點和沸點升高 | |
| C. | 氨溶于水后氨分子和水分子之間形成了氫鍵 | |
| D. | 鄰羥基苯甲酸的熔點比對羥基苯甲酸的熔點高 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 時間/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氧化性:Cl2>Fe3+>I2 | B. | 氧化性:Fe3+>I2>Cl2 | ||
| C. | 還原性:I-<Fe2+<Cl- | D. | 還原性:Cl-<I-<Fe2+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com