
海洋是資源的寶庫,海水中幾乎存在所有的天然元素。海洋資源化學就是研究從海洋中提取化學物質的學科,除了研究從海洋中提取常量元素外,還研究從海洋中提取微量元素(濃度小于1mg/L)。
(1)海洋中含量最高的鹵素元素在周期表中的位置為 ;與其同周期相鄰且單質為固體的元素原子的核外電子排布式為 。
(2)海洋中元素含量位于前列的元素有氧、氯、鈉、鎂、硫,其離子半徑從大到小的順序為 (用離子符號表示),其中形成的化合物中能發生潮解的是 (用電子式表示)。
(3)微量元素鈹在海水中主要以Be(OH)+形式存在,其性質與鋁元素相似,目前是從綠寶石(主要成分為鈹鋁硅酸鹽Be3Al2Si6O18)中提取,由于鈹是航空、電子、汽車等工業不可替代的戰略金屬材料,因此海水提鈹會成為海洋資源化學新的研究方向。請寫出:
①鈹鋁硅酸鹽的氧化物形式的化學式: 。
②Be(OH)+與強堿溶液反應的離子方程式: 。
(4)下列從海洋中提取或提純物質的生產或實驗流程中,不合理的是 (選填編號)。
a.海水提溴:海水濃縮
 溴蒸氣
溴蒸氣

 液溴
液溴
b.海水提鎂:海灘貝殼
 石灰乳
石灰乳

 MgO
MgO 鎂
鎂
c.海帶提碘:海帶灼燒
 濾液
濾液 含碘有機溶液
含碘有機溶液 碘晶體
碘晶體
d.海鹽提純:海鹽

 精鹽
精鹽

 濾液
濾液
 食鹽晶體
食鹽晶體
(本題8分)(1)第三周期ⅦA族 1s22s22p63s23p4
(2)S2->Cl->O2->Na+>Mg2+ 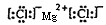
(3)3BeO·Al2O3·6SiO2 Be(OH)++3OH-→BeO22-+ 2H2O (4)bd(2分)
【解析】
試題分析:(1)海洋中含量最高的鹵素元素是氯元素,其原子序數是17,在周期表中的位置為第三周期ⅦA族;與其同周期相鄰且單質為固體的元素是S,原子序數是16,根據構造原理可知S原子的核外電子排布式為1s22s22p63s23p4。
(2)電子層數越多離子半徑越大。在核外電子排布相同的條件下,離子半徑隨原子序數的增大而減小,所以氧、氯、鈉、鎂、硫,其離子半徑從大到小的順序為S2->Cl->O2->Na+>Mg2+。其中形成的化合物中能發生潮解的是氯化鎂,含有離子鍵的離子化合物,其電子式是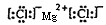 。
。
(3)①再用氧化物形式表示時,活潑金屬的氧化物在前面,然后以此類推,所以根據鈹鋁硅酸鹽的化學式Be3Al2Si6O18可知,其氧化物形式可表示為3BeO·Al2O3·6SiO2。
②由于鈹元素以及化合物的性質與鋁元素以及化合物的性質相似,所以根據氫氧化鋁與氫氧化鈉溶液反應的方程式可知,Be(OH)+與強堿溶液反應的離子方程式為Be(OH)++3OH-→BeO22-+ 2H2O。
(4)根據流程圖可知,ac正確;工業電解氯化鎂冶煉金屬鎂,而不是電解氧化鎂,因為氧化鎂的熔點太高,b不正確;d中氯化鋇過量,引入了雜質Ba2+離子,所以得不到純凈的氯化鈉,應該先加氯化鋇,后加碳酸鈉,過濾后加入鹽酸酸化,d不正確,答案選bd。
考點:考查海水應用的有關判斷;元素周期表的結構和元素周期律的應用等


科目:高中化學 來源: 題型:閱讀理解

查看答案和解析>>
科目:高中化學 來源:2012年人教版高中化學必修二第四章 化學與可持續發展練習卷(解析版) 題型:選擇題
海洋是非常巨大的資源寶庫,以下有關海洋資源開發利用的說法,不正確的有( )
A.海洋約占地球表面積的71%,水儲量達1.3×109億噸,故人類不存在缺水問題
B.海水資源的利用包括水資源的利用和化學資源的利用,兩者可以綜合進行
C.海水中除H2O外,還含有Cl、Na、K、Mg、Ca、S、F等多種元素的化學資源
D.由于與巖石、大氣和生物相互作用,海水中溶解和懸浮有大量無機物和有機物
查看答案和解析>>
科目:高中化學 來源:2014屆內蒙古高一下學期期末考試化學試卷(解析版) 題型:選擇題
海洋是非常巨大的資源寶庫,以下有關海洋資源開發和利用的說法,不正確的有( )
A.海洋約占地球表面積的71%,水儲量達1.3 109億噸,故人類不存在缺水問題
109億噸,故人類不存在缺水問題
B.海水資源的利用包括水資源的利用和化學資源的利用,兩者可以綜合進行
C.海水中除H2O外,還含有Cl、Na、K、Mg、Ca、S、F等多種元素的化學資源
D.由于與巖石、大氣和生物相互作用,海水中溶解和懸浮有大量無機物和有機物
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
我國有較長的海岸線,浩瀚的海洋是一個巨大的物質資源和能量的寶庫。目前,世界各國都在研究如何充分利用海洋資源。
(1)全球海水中的溴的儲量豐富,約占地球溴總儲量的99%,故溴有“海洋元素”之稱,海水中溴含量為65mg·L-1。其工業提取法有:
Ⅰ、空氣吹出純堿吸收法。方法是將氯氣通入到富含溴離子的海水中,使溴置換出來,再用空氣將溴吹出,用純堿溶液吸收,最后用硫酸酸化,即可得到單質溴。該方法涉及的反應有:
①_________________(寫出離子方程式);
②3Br2+3CO32-=BrO3-+5Br-+3CO2↑;
③_________________(寫出離子方程式)。
其中反應②中氧化劑是_________,還原劑是___________
Ⅱ、空氣吹出SO2吸收法。該方法基本同⑴,只是將吹出的溴用SO2溶液來吸收,使溴轉化為氫溴酸,然后再用氯氣氧化氫溴酸即得單質溴。
寫出溴與二氧化硫反應的化學方程式 ____________________ 。
Ⅲ、溶劑萃取法。該法是利用單質溴在水中和萃取劑中溶解度的不同的原理來進行的。
實驗室中萃取用到的實驗儀器名稱是 ___________________。
下列可以用于海水中溴的萃取的試劑是 __________。①乙醇,②四氯化碳,③硝酸
 (2)海水中的氘(含HDO 0.03‰)發生聚變的能量,足以保證人類上億年的能源消費,工業上可采用“硫化氫-水雙溫交換法”富集HDO。其原理是利用H2S、HDS、H2O和HDO四種物質,在25℃和100℃兩種不同溫度下發生的兩個不同反應得到較高濃度的HDO。
(2)海水中的氘(含HDO 0.03‰)發生聚變的能量,足以保證人類上億年的能源消費,工業上可采用“硫化氫-水雙溫交換法”富集HDO。其原理是利用H2S、HDS、H2O和HDO四種物質,在25℃和100℃兩種不同溫度下發生的兩個不同反應得到較高濃度的HDO。
右圖為“硫化氫-水雙溫交換法”所發生的兩個
反應中涉及的四種物質在反應體系中的物質的量隨溫
度的變化曲線。寫出100℃時所發生的反應的化學方
程式________________________________________;
工業上富集HDO的生產過程中,可以循環利用的一種
物質是____________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com