
【題目】現有含有少量NaCl、 Na2SO4、Na2CO3等雜質的NaNO3溶液,選擇適當的試劑除去雜質,得到純凈的NaNO3固體,實驗流程如下圖所示。
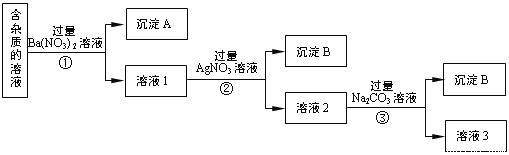
(1)沉淀A的主要成分是_____________、______________(填化學式)。
(2)①②③中均進行的分離操作是_______________。
(3)溶液3經過處理可以得到NaNO3固體,溶液3中肯定含有的雜質是__________,為了除去雜質,可向溶液3中加入適量的______________。
(4)實驗探究小組在實驗中需要用到456 mL1 molL-1的HNO3溶液,但是在實驗室中只發現一瓶8 molL-1的HNO3溶液,該小組用8molL-1的HNO3溶液配制所需溶液。
①實驗中所需的玻璃儀器包括_________、________mL量筒、燒杯、__________、膠頭滴管等。
②該實驗中需要量取8molL-1的HNO3溶液________mL。
③下列實驗操作中導致配制的溶液濃度偏高的是_____________。
A.取8molL-1的HNO3溶液溶液時仰視刻度線
B.量取用的量筒水洗后未進行任何操作
C. 8molL-1的HNO3溶液從量筒轉移至燒杯后用水洗滌量筒并全部轉移至燒杯
D.定容時仰視刻度線
E.定容后,將容量瓶振蕩搖勻后,發現液面低于刻度線,未進行任何操作
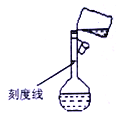
(5)某同學轉移溶液的操作如圖所示,該同學操作中的錯誤是______________________________________。容量瓶的刻度線標在比較細的瓶頸之上的原因是___________。
A.為了美觀 B.為了統一標準 C.為了提高準確度 D.方便刻畫
【答案】BaSO4BaCO3過濾Na2CO3HNO3500mL 容量瓶100玻璃棒62.5AC未用玻璃棒引流C
【解析】
由實驗流程可知,加入過量的Ba(NO3)2,生成BaSO4、BaCO3沉淀,然后在濾液中加入過量的AgNO3,使Cl-全部轉化為AgCl沉淀,在所得濾液中加入過量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,最后所得溶液為NaNO3和Na2CO3的混合物,加入稀HNO3,最后進行蒸發操作可得固體NaNO3;
(1)加入過量的Ba(NO3)2,Na2SO4、Na2CO3和Ba(NO3)2反應生成BaSO4、BaCO3沉淀;
(2)①②③中均進行的分離操作用于分離固體和液體,為過濾操作;
(3)溶液3為NaNO3和Na2CO3的混合物,加入稀HNO3,可除去Na2CO3,最后加熱蒸發、冷卻結晶、過濾得到硝酸鈉;
(4)①實驗室只有500mL的容量瓶,則本實驗需要配制的溶液體積為500mL,另外需要用量筒量8 molL-1的HNO3溶液倒在燒杯中加水溶解,同時需要玻璃棒攪拌,轉移到容量瓶中時也需要玻璃棒引流,最后還需要用膠頭滴管定容,整個實驗需要的玻璃儀器包括500mL 容量瓶、100 mL量筒、燒杯、 玻璃棒、膠頭滴管等;
②設需要量取8 molL-1的HNO3溶液VmL,則8 molL-1×V×10-3L=1 molL-1×500×10-3L,解得:V=62.5;
③A.取8molL-1的HNO3溶液溶液時仰視刻度線,液面在刻度線上方,即濃硝酸的體積偏大,導致配制溶液濃度偏高,故A正確;B.量取用的量筒水洗后未進行任何操作,會稀釋濃硝酸,即濃硝酸的體積偏小,導致配制溶液濃度偏低,故B錯誤;C.量筒量取濃硝酸后,不應該水洗,否則濃硝酸的體積偏大,導致配制溶液濃度偏高,故C正確;D.定容時仰視刻度線,液面在刻度線上方,溶液體積偏大,導致濃度偏低,故D錯誤;E.定容后,除容量瓶振蕩搖勻,不能再加水定容,這樣做對實驗結果無影響,故E錯誤;答案為AC。
(5)轉移溶液的操作如圖所示,錯誤操作是未用玻璃棒引流;容量瓶的刻度線標在比較細的瓶頸之上這樣做的目的是為了提高準確度,與美觀、方便刻畫等沒有關系,故答案為C。


科目:高中化學 來源: 題型:
【題目】在下列操作中,一般情況下不能相互接觸的是( )
A. 過濾時,玻璃棒與三層濾紙
B. 分液時,分液漏斗下端與燒杯內壁
C. 過濾時,燒杯內壁與漏斗下端
D. 用膠頭滴管向試管內滴加液體時,膠頭滴管尖端與試管內壁
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關氫鍵的說法正確的是
A.氫鍵是一種比較弱的化學鍵
B.HF的穩定性很強,是因為其分子間能形成氫鍵
C.乙醇分子與水分子之間形成氫鍵,使乙醇能與水任意比互溶
D.碘化氫的沸點比氯化氫的沸點高是因為碘化氫分子之間存在氫鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【化學——選修3:物質結構與性質】某配位化合物為深藍色晶體,由原子序數依次增大的A、B、C、D、E五種元素組成,其原子個數比為l4︰4︰5︰1︰1。其中C、D元素同主族且原子序數D為C的二倍,E元素的外圍電子排布為(n-1)d n+6nsl。回答下列問題。
(1)元素D在周期表中的位置是 ,B原子的外圍電子排布圖為 。E原子的核外有 種不同運動狀態的電子,B和C的第一電離能大小關系是 。(用元素符號表示)
(2)C元素可與A元素形成兩種常見的化合物,其原子個數比分別為1︰1和l︰2,寫出原子個數比為1︰1的化合物的電子式 ,兩種化合物可以任意比互溶,解釋其主要原因為 。
(3)該配位化合物的化學式為 。
(4)A元素與B元素可形成分子式為A2B2的化合物,該化合物的分子具有平面結構,則其結構式為 ,用電子式表示化合物Na2D的形成過程 。
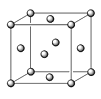
(5)已知E的晶胞結構如圖所示,此晶胞立方體的邊長為a cm,E單質的密度為ρ g·cm-3,則阿伏伽德羅常數為 (用a、ρ表示)。該晶胞配位數為 ,EDC4常作電鍍液,其中DC42-的空間構型是 ,其中D原子的雜化軌道類型是 。若電解EDC4的水溶液,則電解總反應的化學方程式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗的基本操作中,正確的是( )
A.用同一個滴管取用不同的藥品
B.將實驗中剩余的藥品放回原試劑瓶
C.實驗前對實驗裝置進行氣密性檢查
D.將實驗室制備的可燃性氣體直接點燃
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于常溫下pH=3的CH3COOH溶液,下列敘述不正確的是( )
A.c(H+)= c(CH3COO-)+ c(OH-)
B.加入少量CH3COONa固體后,c(CH3COO-)降低
C.該溶液中由水電離出的c(H+)是1.0×10-11 mol/L
D.與等體積pH =11的NaOH溶液混合后溶液顯酸性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯氣是一種重要的工業原料。
(1)寫出實驗室制取氯氣反應的化學方程式________________________。
(2)資料顯示:Ca(ClO)2 +CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O。某學習小組利用此原理設計如圖所示裝置制取氯氣并探究其性質。
2CaSO4+2Cl2↑+2H2O。某學習小組利用此原理設計如圖所示裝置制取氯氣并探究其性質。

①在該實驗中,甲部分的裝置是_______(填字母)。
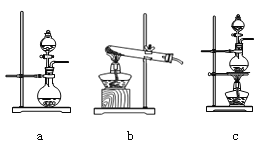
②乙裝置中FeCl2溶液與Cl2反應的離子方程式是________________。
③丙裝置中通入少量Cl2,可制得某種生活中常用的漂白、消毒的物質,這種物質是_______(化學式)。
④有人認為該實驗存在明顯的缺陷,請你將認為缺少的部分在上圖中的相應位置畫出,并在添加的裝置中標明需要放入的最合適的化學試劑。______________
請你寫出Cl2和“④”中“最合適的化學試劑”反應的離子方程式______________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com