
在常溫下,下列各組溶液的c(H+)一定等于1×10-7mol/L的是(溶液混合時忽略體積的變化)( )
A.將pH=5的CH3COOH溶液稀釋100倍
B.0.10mol/L H2SO4與0.10mol/L NaOH溶液等體積混合
C.pH=2和pH=12的兩種溶液等體積混合
D.pH=1的H2SO4與0.05mol/L 的Ba(OH)2溶液等體積混
 仁愛英語同步練習冊系列答案
仁愛英語同步練習冊系列答案 學習實踐園地系列答案
學習實踐園地系列答案科目:高中化學 來源:2017屆貴州省高三模擬四化學卷(解析版) 題型:填空題
【化學——選修3:物質結構與性質】
(1)元素的第一電離能:Al________Si(填“>”或“<”)。
(2)基態Mn2+的核外電子排布式為____________。
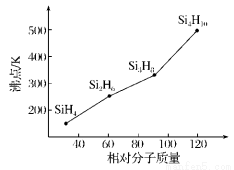
(3)硅烷(SinH2n+2)的沸點與其相對分子質量的變化關系如圖所示,呈現這種變化關系的原因是________________________。
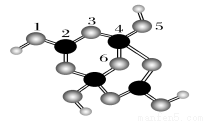
(4)硼砂是含結晶水的四硼酸鈉,其陰離子Xm-(含B、O、H三種元素)的球棍模型如圖所示:
①在Xm-中,硼原子軌道的雜化類型有________;配位鍵存在于________原子之間(填原子的數字標號);m=________(填數字)。
②硼砂晶體由Na+、Xm-和H2O構成,它們之間存在的作用力有________ (填序號)。
A離子鍵 B共價鍵 C金屬鍵 D范德華力 E氫鍵
查看答案和解析>>
科目:高中化學 來源:2016-2017學年陜西省高二上期中化學卷(解析版) 題型:選擇題
如圖是甲醇燃料電池的構造示意圖,該電池總反應式為:2CH3OH+3O2=2CO2+4H2O。下列有關該電池的說法不正確的是( )
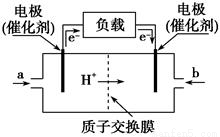
A.等量的甲醇通過燃料電池釋放的電能比其通過火力發電產生的電能多
B.左邊的電極為電池的負極,a處通入的是甲醇
C.電池負極的反應式為:2CH3OH+2H2O-12e-=2CO2↑+12H+
D.若用池電池電解足量飽和食鹽水(石墨電極),消耗1mol甲醇時,產生標況下44.8L氫氣
查看答案和解析>>
科目:高中化學 來源:2016-2017學年陜西省高二上期中化學卷(解析版) 題型:選擇題
室溫下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的變化曲線如圖所示。下列說法正確的是( )
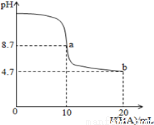
A.a點所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.b點所示溶液中c(A-)> c(HA)
C.a、b兩點所示溶液中水的電離程度相同
D.pH=7時,c(Na+)= c(A-)+ c(HA)
查看答案和解析>>
科目:高中化學 來源:2017屆天津市高三上月考三化學試卷(解析版) 題型:填空題
氮及其化合物在工農業生產生活中應用廣泛,請解決下列問題。
(1)化合物甲(由氮和另一種常見的主族元素組成)是一種新型無機材料。將 8.2g 甲溶于足量的氫氧化鈉溶液,可產生標準狀況下為 4.48L 的氣體,該氣體可作制冷劑。向反應后的溶滾中逐滴加入稀鹽酸,產生白色沉淀質量最大為 15.6g,繼續滴加沉淀消失。則甲溶于氫氧化鈉的化學方程式為_____________________。
(2)NH3催化還原氮氧化物是目前應用廣泛的煙氣氮氧化物脫除技術。例如:
4NH3(g)+6NO(g) 5N2(g)+6H2O(g) △H1
5N2(g)+6H2O(g) △H1
己知:①H2O(l)=H2O(g) △H2
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3
則 NH3(g)的標準燃燒熱△H=____________________。
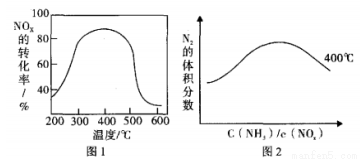
(3)以FeSO4作催化劑在不同溫度下,經過相同的時間測試氨還原氮氧化物效果如圖1,當反應在400~450℃,NOx 的轉化率隨溫度升高而降低。當體系溫度升至 500℃以上時. NOx 的轉化率迅速下降,其可能原因是______________________。圖2反映的是在400℃N2的體積分數與反應物中 c(NH3)/c(NOx)的關系,請在下面的圖2上畫出450℃的變化趨勢曲線。
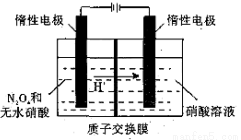
(4)N2O5 是綠色硝化試劑,溶于水可得硝酸。下圖是以 N2O4為原料電解制備N2O5的裝置示意圖。寫出陽極區生成 N2O5 的電極反應式是________________。
(5)常溫下,向 0.1mol/L 氨水中加入少許 N2O5,使溶液中 c(NH3·H2O):c(NH4+)=5:9,此時溶液的 pH=___________。( 25℃時. NH3·H2O 的電離平衡常數 Kb=1.8×10-5)
查看答案和解析>>
科目:高中化學 來源:2017屆天津市高三上月考三化學試卷(解析版) 題型:選擇題
下列敘述正確的是
A.做“鈉與水的反應”實驗時.切取綠豆大小的金屬鈉,用濾紙吸干表面煤油,放入燒杯中,滴入兩滴酚酞溶液,再加入少量水,然后觀察并記錄實驗現象
B.將KI和FeCl3溶液在試管中混合后,加入CCl4,振蕩,靜置;下層液體顯紫紅色;則氧化性:Fe3+>I2
C.測定等濃度的Na2CO3和Na2SO3 溶液的pH;前者pH 比后者的大;則非金屬性: S>C
D.溴乙烷與 NaOH 溶液共熱后,加入AgNO3溶液;未出現淡黃色沉淀;說明溴乙烷沒有水解
查看答案和解析>>
科目:高中化學 來源:2017屆寧夏高三上月考二化學卷(解析版) 題型:填空題
研究NOx、CO等大氣污染物的測量及處理具有重要意義。
(1)在汽車尾氣系統中裝置催化轉化器,可有效降低NOx的排放。NOx在催化轉化器中被CO還原成N2排除。寫出NO被CO還原的化學方程式:________________。
(2)選擇性催化還原技術(SCR)是目前最成熟的煙氣脫硝技術,即在金屬催化劑作用下,用還原劑(如NH3)選擇性地與NOx反應生成N2和H2O。
①已知:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)△H=-905.5kJ•mol-1
4NO(g)+6H2O(g)△H=-905.5kJ•mol-1
N2(g)+O2(g) 2NO(g)△H=+180kJ•mol-1
2NO(g)△H=+180kJ•mol-1
完成該方法中主要反應的熱化學方程式
4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g)△H=_________________。
4N2(g)+6H2O(g)△H=_________________。
②該方法應控制反應溫度在315~400℃之間,反應溫度過低會影響反應速率,但溫度也不宜過高,原因是___________________。
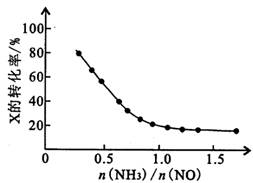
③氨氮比[n(NH3)/n(NO)]會直接影響該方法的脫硝率。350℃時,只改變氨氣的投放量,反應物x的轉化率與氨氮比的關系如右圖所示,則X是________________ (填化學式)。當n(NH3)/n(NO)>1.0時,煙氣中NO濃度反而增大,主要原因是________________ 。
(3)通過NOx傳感器可監測NOx的含量,其工作原理示意圖如下:
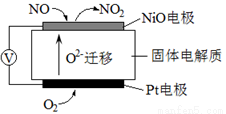
①Pt電極上發生的是______________反應(填“氧化”或“還原”)。
②寫出NiO電極的電極反應式:___________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com